(wer neben den hier im Artikel zu findenden Abbildungen noch an weiteren Bildern und Videos zum Micropatterning interressiert ist, findet unter Biologie Bildergalerien noch eine Galerie mit einer kleinen Auswahl weiterer Bilder)
Seit den Anfängen der Isolierung von Zellen aus Geweben und ihrer anschließenden Kultivierung außerhalb ihres Organismus wurden verschiedene Zellkulturtechniken entwickelt, um Zellen in vitro beobachten und an ihnen experimentieren zu können. Damit die zellulären, physiologischen Prozesse außerhalb des Ursprungsgewebes aufrechterhalten werden, müssen kontrollierte Bedingungen eingehalten werden. Die gängige Praxis besteht darin, Zellen unter sterilen Bedingungen in halbsynthetischen Medien und als Monolayer am Boden spezieller Kulturgefäße (meist Plastik-/Glasschalen) zu kultivieren. Ist erst die richtige Zusammensetzung des benötigten Mediums und die richtige Handhabung der Zelllinie geregelt, kann eine Vielzahl von molekular-/zellbiologischen und biophysikalischen Untersuchungen an den Zellen vorgenommen werden. Ein einfaches Beispiel wäre die Lokalisierung eines bestimmten Proteins in einer Zelle.
Die klassische Kultivierung von Zellen in einfachen Plastik-/Glasschalen bietet viele Möglichkeiten zur Untersuchung zellulärer Prozesse, wie im zuvor genannten Beispiel für erste Untersuchungen zur Lokalisierung eines Proteins. Mögliche Fehlerquellen durch die artifiziellen in vitro Bedingungen können jedoch die Ergebnisse verfälschen, da Zellen in ihrer ursprünglichen Umgebung weiteren biologischen Bedingungen ausgesetzt sind, welche in der klassischen Zellkultur abhandenkommen aber Einfluss auf das Verhalten bzw. die Eigenschaften von Zellen haben können. Des Weiteren zeigen Zellen in der klassischen Zellkultur i.d.R. eine Vielzahl an morphologischen Erscheinungsbildern, was die Auswertung von Ergebnissen erschweren kann,
z.B. kann die Auswertung der Lokalisation des in unserem Beispiel untersuchten Proteins zum Teil der subjektiven Wahrnehmung unterliegen oder es bedarf weiterer Methoden,
um eine objektive und quantitative Aussage über die Lokalisation des Proteins treffen zu können.
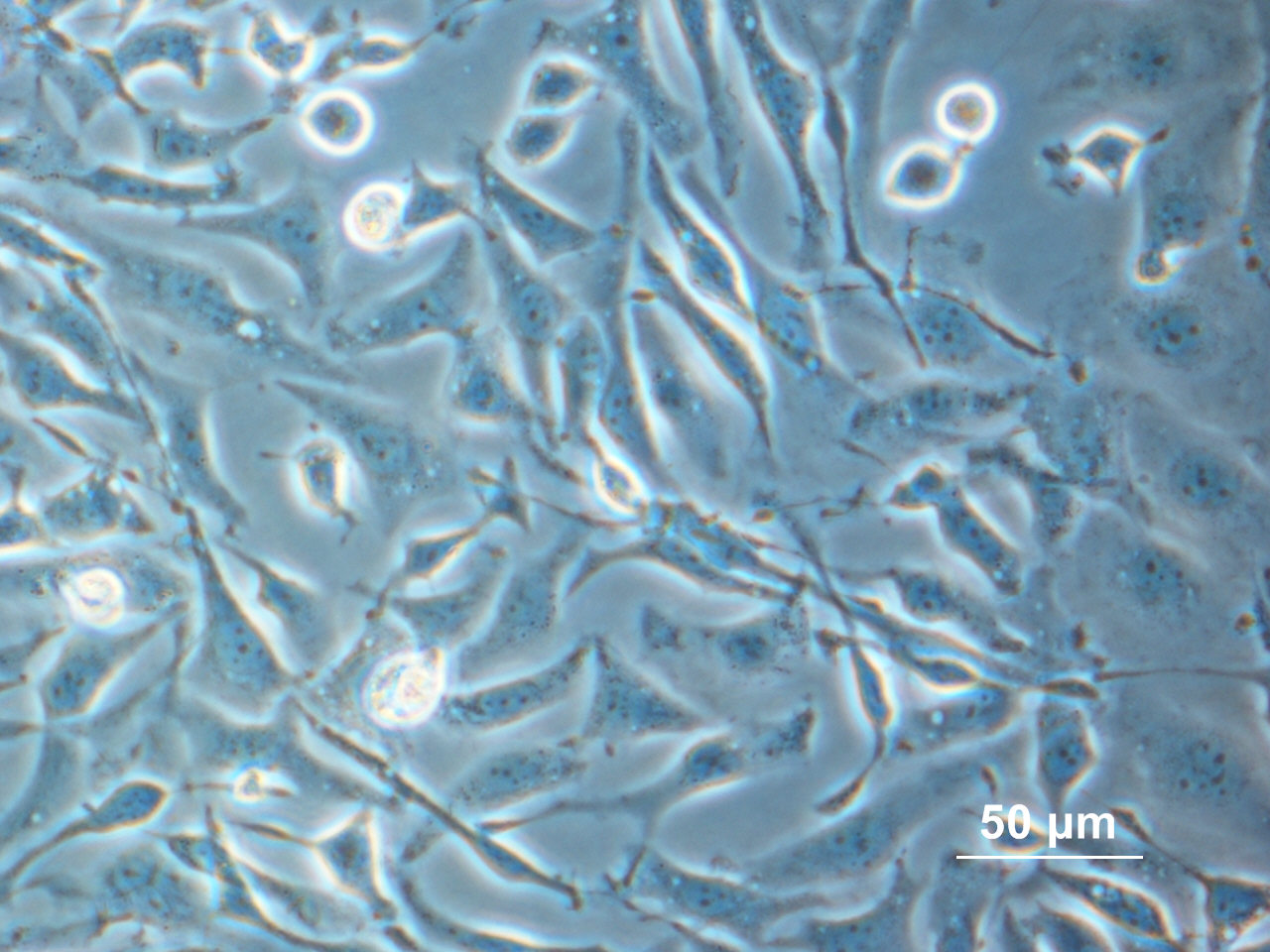 Bild 1: Zellen wie die chinesischen Hamster-Ovarien-Zellen zeigen unter klassischen Zellkulturbedingungen keine einheitliche Morphologie.
Bild 1: Zellen wie die chinesischen Hamster-Ovarien-Zellen zeigen unter klassischen Zellkulturbedingungen keine einheitliche Morphologie.Normalisierung der Zellform
Im Laufe der letzten Jahrzehnte entstanden durch die Kombination von Methoden aus der Molekularbiologie und den Materialwissenschaften neue methodische Ansätze, welche die Kontrolle der Mikroumgebung von Zellen und der Zellarchitektur ermöglichen. An die Nutzung dieser Techniken ist die Hoffnung gebunden, die natürliche Umgebung eines jeden Zelltyps, wie sie in vivo vorzufinden ist, in vitro so exakt wie möglich zu rekonstruieren, sodass die Beobachtung eventueller artifizieller Verhaltensmuster von isolierten Zellen außerhalb des Organismus minimiert werden. Zu diesen Methoden gehört auch das Cell micropatterning, welches u.a. eine genaue Positionierung von Zellen, die Kontrolle über deren Geometrie und über ihr Ausbreitungsverhalten auf dem Substrat ermöglicht.
Bild 2: Mit Hilfe einer Kombination von Methoden aus der Molekularbiologie und der Materialwissenschaften ist es inzwischen möglich, die genaue Positionierung und die Morphologie von Zellen zu steuern wie es am Beispiel von Cortactin-gelabelten RPE1-Zellen in diesem Bild gezeigt wird. Mit freundlicher Genehmigung von ©Manuel Théry
Die Grundlage dieser Technik beruht darauf, das Substrat so zu modifizieren, dass adhäsive und nicht-adhäsive Regionen entstehen, sodass sich bei anschließender Kultivierung von Zellen auf dem modifizierten Substrat Zellen nur auf den adhäsiven Bereichen ansiedeln und ausbreiten können. Diese adhäsiven Regionen, auch micropatterns genannt, können in verschiedenen Formen generiert werden und bestehen i.d.R. aus einem zelladhäsiven Protein der extrazellulären Matrix (z.B. aus Fibronektin, Kollagen oder Laminin), dem komplexen Netzwerk von sezernierten Proteinen und Kohlenhydraten, welches in vivo den interzellulären Raum füllt und primär als eine Fixierungsmöglichkeit für die in ihm eingebetteten Zellen dient.
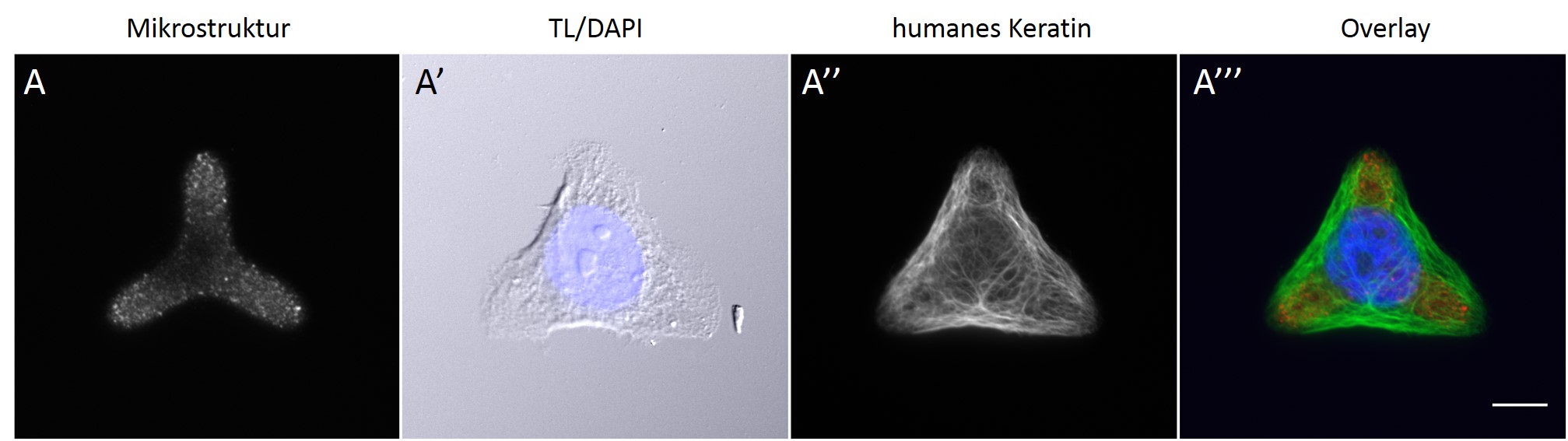 Bild 3: Eine humane Keratinozyte der Zelllinie HaCaT auf einer Mikrostruktur. Nach Ansiedlung auf einer Mikrostruktur (A) versucht die Zelle sich der Form und der Größe der Mikrostruktur anzupassen, wobei jedoch die Ausbreitungsfläche der Zelle je nach Form der Mikrostruktur größer ausfallen kann als die tatsächliche Mikrostruktur. Mit Hilfe einer Immunfluoreszenzfärbung können intrazelluläre Elemente wie der Zellkern (A´) und das Keratin-Netzwerk (A´´) sichtbar gemacht und für eine bessere Übersicht ein Overlay (A´´´) der Strukturen erstellt werden.
Bild 3: Eine humane Keratinozyte der Zelllinie HaCaT auf einer Mikrostruktur. Nach Ansiedlung auf einer Mikrostruktur (A) versucht die Zelle sich der Form und der Größe der Mikrostruktur anzupassen, wobei jedoch die Ausbreitungsfläche der Zelle je nach Form der Mikrostruktur größer ausfallen kann als die tatsächliche Mikrostruktur. Mit Hilfe einer Immunfluoreszenzfärbung können intrazelluläre Elemente wie der Zellkern (A´) und das Keratin-Netzwerk (A´´) sichtbar gemacht und für eine bessere Übersicht ein Overlay (A´´´) der Strukturen erstellt werden.
Methoden zum micropatterning
Am Anfang des Prozesses wird meist auf die Techniken der Fotolithographie und/oder der Softlithographie zurückgegriffen, um einen Stempel oder eine Art Schablone, welche die gewünschten Mikrostrukturen tragen, herzustellen. Es existieren viele verschiedene Methoden, um Substrate mit Mikrostrukturen zu versehen. Die bekannteste Methode ist die Technik des microcontact printing (µCP). Hierbei wird ein elastischer Stempel aus PDMS hergestellt, der auf der Oberfläche die gewünschten Mikrostrukturen trägt. Im nächsten Schritt wird die mikrostrukturierte Oberfläche des Stempels mit dem gewünschten Protein beschichtet und die Protein-beschichtete, strukturierte Stempelseite anschließend mit einem Substrat in Kontakt gebracht. Durch den mechanischen Kontakt können die Adhäsionsproteine auf das Substrat übertragen werden. Die nicht bedruckten Regionen werden durch eine anti-adhäsive Lösung geblockt, sodass Zellen sich nur auf den Mikrostrukturen ansiedeln und ausbreiten können
 Bild 4: Bei der Methode des microcontact printing Methode wird ein elastischer Stempel wie z.B. aus dem Material Polydimethylsiloxan (PDMS) mit einer strukturierten Oberfläche hergestellt. Nachdem die strukturierte Oberfläche mit einem Zelladhäsionsprotein überzogen wurde, kann durch den Kontakt des Stempels mit einem Substrat das Adhäsionsprotein auf die Unterlage übertragen werden.
Bild 4: Bei der Methode des microcontact printing Methode wird ein elastischer Stempel wie z.B. aus dem Material Polydimethylsiloxan (PDMS) mit einer strukturierten Oberfläche hergestellt. Nachdem die strukturierte Oberfläche mit einem Zelladhäsionsprotein überzogen wurde, kann durch den Kontakt des Stempels mit einem Substrat das Adhäsionsprotein auf die Unterlage übertragen werden.Eine weitere Methode zur Generierung strukturierter Substrate besteht darin, eine Schablone mit Mikrostrukturen, welche als durchlässige Bereiche in die Schablone eingelassen sind, auf ein Substrat zu legen und auf die Schablone die gewünschte Proteinlösung aufzutragen. Nur im Bereich der Mikrostrukturen kommt es dabei zum Kontakt der Lösung mit dem Substrat. Danach wird die überschüssige Proteinlösung sowie die Schablone entfernt und die nicht bedruckten Regionen werden passiviert, um eine anschließende Zellansiedlung spezifisch im Bereich der Mikrostrukturen zu ermöglichen.
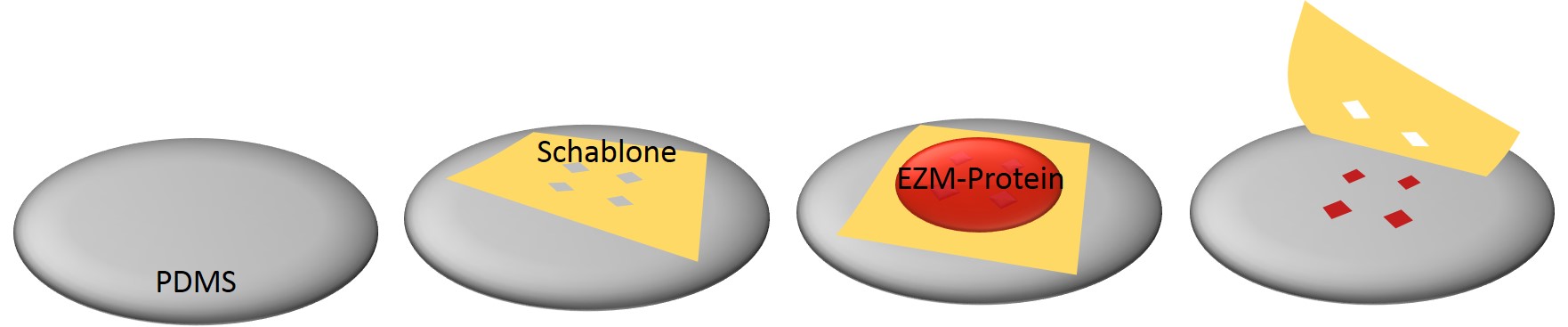 Bild 5: Bei der Methode des stencil patterning wird eine Schablone, in welche Mikrostrukturen als durchlässige Bereiche eingelassen sind, auf ein Substrat gelegt. Wird die Oberfläche der Schablone mit einem Zelladhäsionsvermittler überzogen, kommt dieser über die durchlässigen Bereiche mit dem Substrat in Kontakt und kann von ihm absorbiert werden. Nach dem Entfernen des überschüssigen Adhäsionsvermittlers und der Schablone bleiben die Mikrostrukturen auf dem Substrat zurück.
Bild 5: Bei der Methode des stencil patterning wird eine Schablone, in welche Mikrostrukturen als durchlässige Bereiche eingelassen sind, auf ein Substrat gelegt. Wird die Oberfläche der Schablone mit einem Zelladhäsionsvermittler überzogen, kommt dieser über die durchlässigen Bereiche mit dem Substrat in Kontakt und kann von ihm absorbiert werden. Nach dem Entfernen des überschüssigen Adhäsionsvermittlers und der Schablone bleiben die Mikrostrukturen auf dem Substrat zurück.
Anwendungsgebiete
Es existieren viele weitere komplexere Ansätze zur Herstellung mikrostrukturierter Oberflächen für zellbasierte Anwendungen (siehe Reviews: Yap & Zhang, 2006; Falconnet et. al., 2006). Jede von ihnen weist je nach Fragestellung/Anwendungsgebiet und je nach Zelltyp spezifische Vor- und Nachteile auf. Zum Beispiel eignet sich µCP nicht ohne weiteres für jedes unbehandelte Substrat, da Proteine nicht an jedem Untergrund ideal adhärieren. I.d.R muss zunächst der Untergrund chemisch oder physikalisch modifiziert werden, um eine bessere Adhäsion des Proteins während des mechanischen Kontakts zu gewährleisten. Die Mikrostrukturierungstechniken haben in den letzten Jahrzehnten zu mannigfaltigen Möglichkeiten in der Zellbiologie und zu neuen zellbiologischen Einblicken geführt. Durch die genaue Kontrollierbarkeit der Anordnung und der Morphologie einzelner Zellen kann eine große Anzahl an Zellen desselben Typs mit der gleichen Morphologie kultiviert werden. Dies ermöglicht es zelluläre Prozesse akkurat zu analysieren, um zum Beispiel die Lokalisation eines bestimmten Proteins unter spezifischen Bedingungen zu bestimmen. Die Normalisierung der Zellform führt dabei auch zu einer Normalisierung der intrazellulären Architektur, also einer in allen Zellen vergleichbaren Organisation der intrazellulären Zellbestandteile, sodass mit Hilfe weniger normalisierter Zellen bereits eine exakte Aussage über die durchschnittliche Lokalisation der zellulären Elemente getroffen werden kann.
Zudem können schon kleinste Veränderungen bei veränderten Kulturbedingungen, nach Zugabe von pharmazeutischen Wirkstoffen oder bei mutanten Zelllinien schnell und genau ermittelt werden.
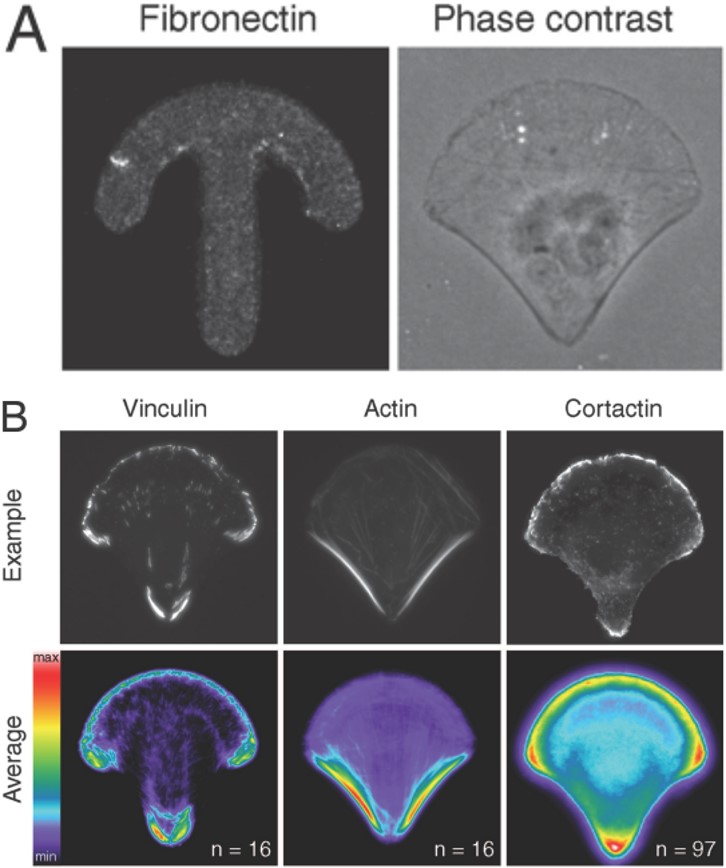
Bild 6: Je nach Methode können Mikrostrukturen in beliebiger Form und Größe bestehend aus einem beliebig wählbaren Adhäsionsvermittler (hier Fibronektin) generiert werden (A links), auf welchen Zellen ansiedeln und wachsen können (A rechts). Eine anschließende Antikörperfärbung zur Visualisierung von zellulären Elementen zeigt eine hochstrukturierte Lokalisation der zellulären Bestandteile (B oben). Dadurch ist es möglich, von den Aufnahmen ein Overlay zu erstellen und z.B. die durchschnittliche Verteilung eines untersuchten Proteins zu errechnen (B unten). Théry et al. (2006) in PNAS.
Mikrostrukturen können in verschiedenen Formen und Größen generiert werden. Dies ermöglicht es den Einfluss von Substratgeometrie und der Größe der Ausbreitungsfläche auf Zellen zu ermitteln. Diverse Studien konnten belegen, dass Form und Größe von Mikrostrukturen ausschlaggebend für die Regulierung diverser Zellfunktionen wie Proliferation, Apoptose, Migration, Differenzierung, Anordnung von zellulären Elementen und der Dynamik des Zytoskeletts sein können. (Chen et al., 1997; Théry et al., 2006; Parker et al., 2002; Kilian et al., 2010). Des Weiteren ist es möglich, Mikrostrukturen zu generieren, die die Ansiedlung von zwei Zellen in räumlicher Nähe zueinander und somit die Entwicklung von Zell-Zellkontakten fördern. Solche Mikrostrukturen eignen sich zur Analyse von Zellkontakten und der Interaktion zweier angrenzender Zellen. Größere Mikrostrukturen, auf denen sich mehrere Zellen ansiedeln können,
sind für das Verständnis des wechselseitigen Verhältnisses von Form und Funktion in Zellverbänden interessant. An endothelialen Zellen konnte beobachtet werden, dass die Zellproliferation von Zellen in Zellverbänden in Randbereichen adhäsiver Mikrostrukturen größer ist (Nelson et al., 2005), eine Beobachtung, welche während der Wundheilung und der Embryonalentwicklung ebenfalls beobachtet werden kann.
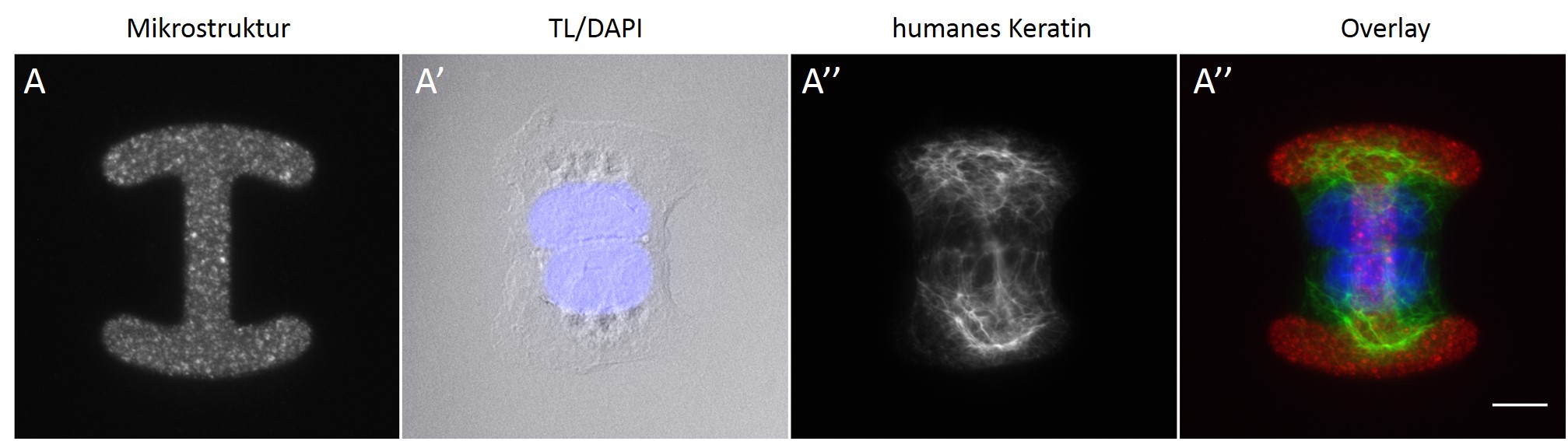 Bild 7: Je nach Form und Größe der Mikrostrukturen können diese von einer oder mehreren Zellen besiedelt werden. Solche Mikrostrukturen eignen sich besonders gut zur Untersuchung der Interaktion mehrerer Zellen.
Bild 7: Je nach Form und Größe der Mikrostrukturen können diese von einer oder mehreren Zellen besiedelt werden. Solche Mikrostrukturen eignen sich besonders gut zur Untersuchung der Interaktion mehrerer Zellen.Eine weitere Möglichkeit, Mikrostrukturen zur Analyse des Zellverhaltens einzusetzen, besteht darin, das Design der Mikrostrukturen so zu gestalten, dass Zellen entlang dieser wandern. Seit jeher liegt ein besonderes Augenmerk der Forschung auf der Analyse der Zellmigration, da ihr eine wichtige Bedeutung während der Embryogenese, der Morphogenese von Geweben und Organen, der Immunantwort und nicht zuletzt der Metastasenbildung zukommt. Die einfachste Mikrostruktur zur Steuerung der Zellmigration ist die Streifenform. Neben der Möglichkeit, während eines Experimentes eine große Anzahl migrierender Zellen in einem kleinen Bereich zu analysieren, können auch Prozesse wie contact inhibition of locomotion (CIL), ein Prozess bei dem eine Zelle ihre Migrationsrichtung nach Kontakt/Kollision mit einer weiteren Zelle ändern kann, effizienter analysiert werden, da die Wahrscheinlichkeit eines solchen Zusammentreffens durch den Einsatz von Mikrostrukturen in Form von Streifen erhöht wird.
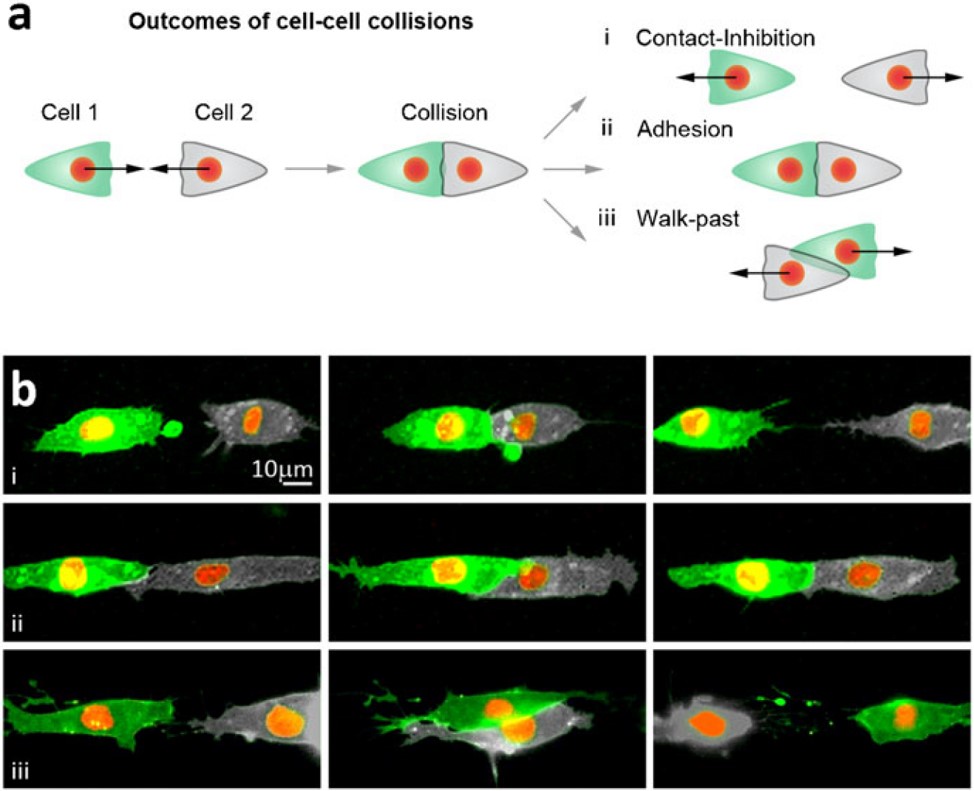
Bild 8: Hier ein Beispiel, wie Streifen-Mikrostrukturen genutzt werden können, um das Verhalten zweier, kollidierender Zellpopulation zu analysieren. a: Dargestellt sind die verschiedenen Ausgangsmöglichkeiten nach einer Kollision zweier Zellen bei einer Untersuchung auf contact inhibition of locomotion. Wenn zwei verschiedene Typen von Xenopus Neuralleistenzellen entlang der Streifen-Mikrostrukturen wandern und miteinander kollidieren, können diese anschließend entweder in entgegengesetze Richtungen wandern (oben), aneinander haften (mitte) oder aneinander entlanggleiten (unten). Scarpa et al. (2013) in Biology Open.
Neben der Möglichkeit Mikrostrukturen auf steifen Substraten wie Plastik-/Glasschalen aufzubringen, können weichere Substrate, bestehend aus elastischen und deformierbaren Materialien, ähnlich modifiziert werden. Dies hat den Vorteil, dass neben der Geometrie auch die mechanische Beschaffenheit der in vivo Mikroumgebung in vitro nachgeahmt werden kann. In Kombination mit weiteren Techniken z.B. aus der 3D-Zellkultur ist Cell micropatterning in der Biomedizin ein wichtiges Werkzeug zur Rekonstruktion der in vivo vorzufindenden Mikroumgebung von Zellen und ein Schritt Richtung Tissue Engineering.
Literatur
Chen, C.S., Mrksich, M., Huang, S., Whitesides, G.M., and Ingber, D.E. (1997). Geometric Control of Cell Life and Death. Science 276, 1425-1428.
Kilian, K.A., Bugarija, B., Lahn, B.T., and Mrksich, M. (2010). Geometric cues for directing the differentiation of mesenchymal stem cells. Proceedings of the National Academy of Sciences 107, 4872-4877.
Maiuri, P., Terriac, E., Paul-Gilloteaux, P., Vignaud, T., McNally, K., Onuffer, J., Thorn, K., Nguyen, P.A., Georgoulia, N., Soong, D., et al. (2012). The first World Cell Race. Current Biology 22, R673-R675.
Nelson, C.M., Jean, R.P., Tan, J.L., Liu, W.F., Sniadecki, N.J., Spector, A.A., and Chen, C.S. (2005). Emergent patterns of growth controlled by multicellular form and mechanics. PNAS 102, 11594-11599.
Parker, K.K., Brock, A.L., Brangwynne, C., Mannix, R.J., Wang, N., Ostuni, E., Geisse, N.A., Adams, J.C., Whitesides, G.M., and Ingber, D.E. (2002). Directional control of lamellipodia extension by constraining cell shape and orienting cell tractional forces. The FASEB Journal 16, 1195-1204.
Scarpa, E., Roycroft, A., Theveneau, E., Terriac, E., Piel, M., and Mayor, R. (2013). A novel method to study contact inhibition of locomotion using micropatterned substrates. Biology Open 2, 901-906.
Théry, M., Pépin, A., Dressaire, E., Chen, Y., and Bornens, M. (2006a). Cell distribution of stress fibres in response to the geometry of the adhesive environment. Cell Motility and the Cytoskeleton 63, 341-355.
Théry, M., Racine, V., Piel, M., Pépin, A., Dimitrov, A., Chen, Y., Sibarita, J.-B., and Bornens, M. (2006b). Anisotropy of cell adhesive microenvironment governs cell internal organization and orientation of polarity. Proceedings of the National Academy of Sciences 103, 19771-19776.
[printfriendly]