1 Tunikaten
Tunikaten faszinieren Wissenschaftler schon lange und auch in der Entwicklungsbiologie wurden bereits früh Untersuchungen an ihnen durchgeführt. Diese Faszination lässt sich unter anderem darauf zurückführen, dass Tunikaten anatomische, physiologische und embryologische Ähnlichkeiten mit Cephalochordaten und Vertebraten aufweisen, was auf die nahe Verwandtschaft zurückzuführen ist. In der Systematik bilden die Cephalochordaten den basaleren Unterstamm der Chordaten, während Tunikaten, laut neueren Untersuchungen, als eine Schwestergruppe der Vertebraten angesehen werden (Lemaire, 2011).
Aufgrund ihrer einfachen Haltung und Zugänglichkeit für biologische Methoden ist diese Verwandtschaftsbeziehung besonders interessant, da sich dadurch an Tunikaten gewonnene Erkenntnisse potentiell speziell auf Vertebraten und damit auch auf den Menschen übertragen lassen. Ein Beispiel hierfür ist, dass Tunikaten traditionell als eine der Hauptquellen für Bestandteile von Krebsmedikamenten bekannt sind (Tohme et al., 2011).
Ein weiterer Grund für die Faszination der Wissenschaft für Tunikaten ist die Namengebende „Tunika“ aus Tunicin, welches eine hohe Ähnlichkeit mit der aus Pflanzen bekannten Cellulose besitzt und irreführenderweise häufig mit dieser gleichgesetzt wird.
2 Experimentelle Untersuchungen an Embryonen
Zu den bekanntesten und am häufigsten zitierten Beobachtungen und Experimenten der Entwicklungsbiologie gehören die bereits 1887 gemachten Beobachtungen und Experimente zur Furchung und der damit zusammenhängenden Determination des Zellschicksals an Tunikaten, welche 1905 von Conklin weitergeführt wurden (Conklin, 1905). Bereits 1887 stellte Chabry fest, dass das Entfernen einzelner Blastomere das Fehlen spezifischer larvaler Strukturen verursachte, die isolierten Zellen jedoch unabhängig vom restlichen Embryo die entsprechenden Strukturen ausbilden konnten (Chabry. 1888). Conklin verfolgte 1905 auf Basis dieser Erkenntnis und der Beobachtung, dass verschiedene Regionen des Cytoplasmas der Ascidie Styela eine unterschiedliche Pigmentierung aufweisen, das Zellschicksal aller Zellen bis ins Larvenstadium.
3 Furchung der Tunikaten am Beispiel der Ascidien
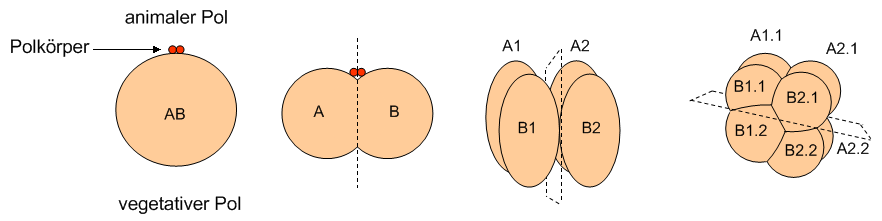
Abb. 1 Schematisches Furchungsmuster von einem Ei der Seescheide Halocynthia rosetryi. Die erste Furchung verläuft meridional und teilt den Embryo in eine rechte und eine linke Hälfte, die zweite Furchung verläuft ebenfalls meridional, aber um 90° versetzt gegen die vorherige Teilungsebene.
Modifiziert nach Wolpert (1999) in Entwicklungsbiologie
Die Entwicklung der Tunikaten wird zumeist am Beispiel von Ascidien, der größten Gruppe der Tunikaten, erläutert und folgt einem bilateralen holoblastischen Furchungsmuster, wobei der Furchungstyp unveränderlich und stereotyp ist, was bedeutet, dass bei Individuen einer Art wenige bis keine Variationen während der Entwicklung auftreten. Jede bei einer Zellteilung auftretende Zelle besitzt ein spezifisches und unflexibles Zellschicksal. Geht eine dieser Zellen verloren, so können die entsprechenden Strukturen, welche von der Zelle gebildet werden sollten, nicht mehr entstehen.
Dieses Zellschicksal wird durch die Zusammensetzung des Cytoplasmas und der darin enthaltenen cytoplasmatischen Faktoren bestimmt, wobei bereits die unbefruchtete Eizelle durch eine animal-vegetale Achse gekennzeichnet ist, entlang der im Zytoplasma durch bereits existierende cytoplasmatische Faktoren bereits die zukünftigen Regionen vom animalen zum vegetalen Pol hin vorbestimmt sind, welche das Ektoderm, Mesoderms und das Endoderms bilden.
Die Bilateralsymmetrie wird daraufhin bei den folgenden Teilungen bis hin zur Gastrulation immer deutlicher erkennbar.
Die frühe Gastrulation beginnt bei Ascidien im 76-Zell Stadium indem die vegetale Platte abzuflachen beginnt. Im 110-Zell Stadium verengen sich die apikal gelegenen Zellen der Ventralplatte, während sich die Platte nach innen einstülpt, welche das spätere Endoderm darstellt. Diese Invagination bildet einen Blastoporus an dessen Rand die Mesodermzellen entstehen. Diese beginnen daraufhin einzuwandern, wobei die anterior gelegenen Zellen die Vorläufer des zukünftigen Notochords darstellen, während die posterioren Zellen die Muskelzellen des Schwanzes ausbilden. Lateral am Blastoporus befinden sich außerdem die Vorläuferzellen des Mesenchyms.
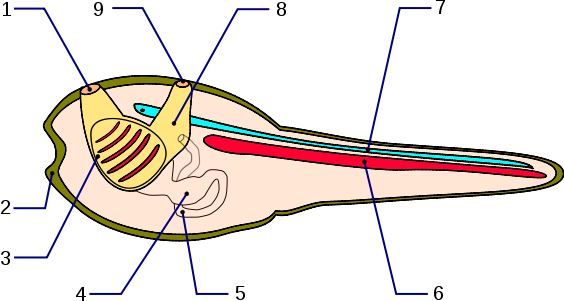
Abb. 2 Larve von Ciona mit den wichtigsten Merkmalen der Chordatiere. 1: Ingestionsöffnung, 2: Haftpapillen, 3: Pharynx (Kiemendarm), 4: Magen, 5: After, 6: Chorda dorsalis, 7: Neuralrohr
Foto: Esculapio
Lizenz: Creative Commons Attribution-Share Alike 2.5 Generic
Die Originaldatei ist hier zu finden.
Nach der Invagination migrieren die Mesodermzellen entlang der Oberfläche der Endodermzellen und die Ektodermzellen flachen ab und überwachsen die mesodermalen und endodermalen Zellen, bis sie den Embryo umschließen, womit die Gastrulation abgeschlossen ist. Anschließend streckt sich der Embryo entlang der anterior-posterioren Achse. Die dorsal angelegten Ektodermzellen invaginieren und werden von der Neuralfalte umschlossen, wodurch das Neuralrohr gebildet wird, dessen anteriores Ende das Gehirn und dessen posteriores Ende das Rückenmark bildet. Die Vorläuferzellen des Notochords an den beiden Seiten des Embryos wandern in Richtung der Mittelachse, verzahnen miteinander und bilden das Notochord. Die Vorläuferzellen der Schwanzmuskulatur differenzieren auf beiden Seiten des Neuralrohrs bzw. des Notochords. Am Ende dieser Entwicklung ist die typische Struktur einer Tunikaten-Larve, welche Merkmale der Vertebraten in Form von Notochord, dorsalem Neuralrohr, postanalem Schwanz, Kiemendarm sowie ein Endostyl besitzt, erkennbar (Abb. 2).
Eine daraus resultierende interessante Beobachtung beim Vergleich mit Vertebraten ist das Fehlen von Zellmigration (Munro et al., 2006). Schließt man die Zellbewegungen während der Schwanzbildung aus, ist während der Embryonalentwicklung von Ascidien zu beobachten, wie sich Zellen in der Regel an Nachbarzellen anheften. In Vertebraten ist jedoch zu beobachten, wie sich Zellen voneinander lösen und in andere Bereiche migrieren. Ein bekanntes Beispiel dafür stellen Zellen der Vertebraten dar, welche das Mesoderm bilden: in dem zuvor aus zwei Keimblättern bestehenden Embryo wandern spezifische Zellen in das Innere des Embryos, um das dritte Keimblatt, das Mesoderm, zu bilden. Während der Gastrulation der Ascidien ist jedoch keine Zelldissoziation und Zellmigration zu beobachten. Stattdessen flacht zunächst, wie bereits erwähnt, die Ventralplatte ab und stülpt sich ein, um die Gastrula zu bilden. Das Mesoderm entsteht aus Zellen, welche sich im Bereich des Blastoporus befinden und im Zuge der fortschreitenden Gastrulation in den inneren Bereich der Gastrula gelangen, ohne dabei zu dissoziieren.
4 Systematik

Abb. 3 Kladogramm phylogenetischer Verwandtschaften zwischen Tunikaten Ordnungen bzw. Unterordnungen und anderen Tiergruppen von wissenschaftlichem Interesse anhand von 18S RNA Analysen.
nach Lemaire (2011) in Development
Tunikaten werden traditionell in drei Subtaxa im Rang von Klassen eingeteilt:
1. Ascidiacea
2. Thaliacea und
3. Larvacea
Jedoch stellen Ascidien keine monophyletische Gruppe dar. Neueste Untersuchungen weisen auf eine phylogenetische Verwandtschaft hin, wie sie in Abbildung 3 gezeigt wird.
Die Ascidien („ascidian“ abgeleitet vom griechischen askidion für kleine Vase), auch Seescheiden genannt, stellen die diverseste Gruppe innerhalb der Tunikaten dar, welche auch die prominentesten Modellorganismen wie Ciona intestinalis, Halocynthia roretzi und Botryllus schlosseri umfasst. Die frei-schwimmende Larvenform entwickelt sich im Zuge einer Metamorphose zu einer sessilen, adulten Lebensform, welche an ein Substrat angeheftet ist.
Auch die frei-schwimmenden Larvenformen der Thaliaceen („thalia“ abgeleitet vom griechischen für „blühend“, eine Anspielung auf die schnelle Proliferation der Thaliaceen) durchleben eine Metamorphose, wobei ihre Entwicklung einem weit komplexeren Generationswechsel unterworfen ist. Die drei Untergruppen der Thaliaceen, die Salpen (Salpida), die Dolioliden (Doliolida) und die Feuerwalzen (Pyrosomatida) werden nach neusten Untersuchungen innerhalb der Ascidien eingeordnet (Lemaire, 2011). Die planktonisch-lebenden Thaliaceen bewegen sich dabei mit Hilfe einer Art Drüsenantriebs fort.
Die planktonisch und solitär lebenden Larvaceen, auch als Appendicularia bekannt, behalten ihr Leben lang die Larvenform. Der Modellorganismus Oikopleura dioica stellt den vermutlich bekanntesten Vertreter der Larvaceen dar.
4.1 Larvacea
Larvacea, auch als Appendicularia bekannt, haben im Schnitt eine Rumpfgröße von etwa 0,5 cm und einen Schwanz, welcher zusätzlich noch einmal die 4-5fache Länge des Rumpfes besitzt. Ihre Entwicklung weist keine Metamorphose auf. Schwanz, Notochord, Kiemendarm und dorsaler Nervenstrang bleiben zeitlebens bei den Appendicularia erhalten. Ihre Individuen sind frei-schwimmend und solitär-lebend. Es wird vermutet, dass sich die Appendicularia durch Neotonie aus der Larvenform eines Ascidien-ähnlichen, ursprünglichen Tunikaten entwickelten. Im Gegensatz zur Form typischer Tunikatenlarven besitzen Appendicularia eine gekrümmte Erscheinung, mit einer Krümmung unterhalb des Rumpfes, in welchem sich die wichtigsten Organe befinden. Diese Organe sind das Verdauungssystem, die Reproduktionsorgane, die zwei Cilien-tragenden Kiemenöffnungen, welche zum Pharynx führen, das Endostyl und das Herz.
Eine besondere Struktur stellt das Gehäuse der Appendicularia dar, welches als der komplexeste, äußere Filterapparat im Tierreich angesehen wird.
Das Gehäuse wird vom oikoplastischen Epithelium, einer einzelnen Epithelschicht über dem Rumpf, sekretiert, und besteht aus einer gallertigen Tunika, welche wiederum aus Mucopolysacchariden besteht. Die sekretierte Struktur expandiert und wird als Filternetz eingesetzt, um Nahrungspartikel einzusammeln.
Die drei Familien (Oikopleuridae, Fritillariidae, Kowalevskiidae) besitzen unterschiedliche Gehäuse mit unterschiedlicher Funktionsweise.
Die Individuen der Familie der Oikopleuridae befinden sich im Inneren des von ihnen produzierten Gehäuses und drücken, durch das Schlagen ihres Schwanzes, das Wasser durch die zwei Filter, welche außen an das Gehäuse angelegt sind und durchlässig für kleinere Partikel sind. Die Partikel gelangen durch innen angelegte Filter, bis die Cilien im Kiemendarm sie durch einen schleimbenetzten Kanal in den Mund des Tieres führen.
Individuen der Fritillariidae-Familie besitzen dagegen einen einfacher gebauten Komplex. Der hintere Rumpf mit den Gonaden der Individuen ragt aus dem Gehäuse heraus und das Wasser, welches die Nahrungspartikel enthält, wird durch eine vom Schlagen des Schwanzes verursachte Strömung von hinten in Richtung des Gehäuses des Tieres transportiert, zunächst durch einen inneren Grobfilter geleitet hinter dem das eigentliche Filternetz liegt, mit dem die eigentlichen Nahrungspartikel herausgefiltert werden.
Individuen aus der Kowalevskiidae-Familie tragen ein expandiertes, Ballon-artiges Gehäuse vor ihrem Mund, welches sie größtenteils umhüllt (Alldredge, 1976).
Das Gehäuse wird mehrmals im Laufe eines Tages neu regeneriert, einige Spezies regenerieren es alle 3-4 h. Appendicularia können Nahrungspartikel mit einem Durchmesser von 0,1 bis 30 µm zu sich nehmen, womit sie zu den wenigen Metazoen zählen, welche Bakterien und kleinstes Phytoplankton erbeuten können. Ungefähr 70 Arten sind derzeit bekannt (Fenaux 1993) und ihr Lebensraum erstreckt sich auf alle Ozeane der Welt.
Die am besten untersuchte Art, welche gleichzeitig einen der bekannteren Modellorganismen unter den Tunikaten darstellt, ist Oikopleura dioica. Während alle Tunikaten Hermaphroditen sind, stellt O. dioica eine Ausnahme dar, da die Individuen dieser Art die einzig bekannten getrenntgeschlechtlichen unter den Tunikaten sind.
Das Genom dieser Art beträgt lediglich 72 Mb, womit es sich um das bisher kleinste uns bekannte Genom unter den Chordaten handelt (Seo et al. 2001). Trotz des kleinen Genoms gehen Schätzungen von einer Genanzahl von 15.000 Genen aus, was in etwa der Genanzahl von Ciona intestinales, mit einem Genom von 160 Mb entspricht. Intergenische Sequenzen in O. dioica scheinen sehr kurz zu sein und die Größe von Introns liegt in der Regel unter 50 bp, und die Intronpositionen in den einzelnen Genen weicht stark von den Intronpositionen bei anderen Lebewesen ab (Edverdsen et al. 2004). Erste Untersuchungen zeigten, dass Gene in O. dioica, welche eine Größe von 0,8 kb , 1,6 kb oder 2,2 kb besitzen, bei Menschen einer Gengröße von 15 kb, 30 kb bzw. 35 kb entsprechen würden.
4.2 Thaliacea
Innerhalb der pelagisch-lebenden Thaliacea existieren die drei Taxa Salpida, Doliolida und Pyrosomida. Interessanterweise fehlt den meisten Arten der Thaliaceen die ursprüngliche Larvenform wie sie bei den Ascidien vorkommt, bei den Salpida und den Pyrosomida fehlt sie sogar bei allen bekannten Arten. Dieses Fehlen der Larvenform ist auf die sehr komplexe Entwicklung der Thalieceen zurückzuführen, welche einem mehrteiligen Generationswechsel unterworfen ist.
Da über den Lebenszyklus der Pyrosomida bis heute wenig bekannt ist und Literatur dazu nur spärlich vorhanden ist, wird hier nur auf die Lebenszyklen der Salpen und der Dolioliden eingegangen.
4.2.1 Salpen
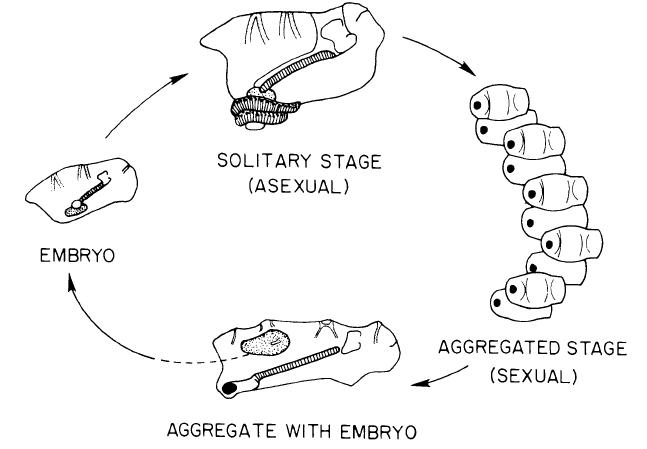
Salpen sind einem Wechsel zwischen einer sexuellen und einer asexuellen Reproduktionsweise unterworfen (Abb 4, Alldredge et al., 1982). Zu Anfang leben die asexuellen Individuen, auch Oozooide genannt, solitär, und bilden zunächst durch Knospung Anhänge an denen bis zu mehrere hundert aneinander gereihte Salpen entstehen können, wodurch sie fortan in einer Kolonie leben.
Erreichen die Knospen das Entwicklungsstadium eines Blastozooiden, lösen sie sich von der Kette, um sich in einem frei-schwimmenden Stadium weiterzuentwickeln. Der Oozooid und seine Knospen sind zu Beginn weiblich und produzieren jeweils eine Eizelle. Nachdem sie sich von der Kette gelöst haben, werden die Eizellen von Spermien älterer, männlicher Individuen befruchtet. Der heranwachsende Embryo bleibt an der Körperwand des Muttertiers befestigt und wird durch eine Plazenta-ähnliche Membran von dem Muttertier ernährt, was Salpen als lebend-gebärdend charakterisiert. Diese Reproduktionsweise weist damit keine Larvenform auf. Der heranwachsende Oozooid wird im nächsten Schritt von dem Blastozooiden entlassen, wobei der Oozooid nun von neuem in den Reproduktionskreislauf eintritt.
4.2.2 Dolioliden
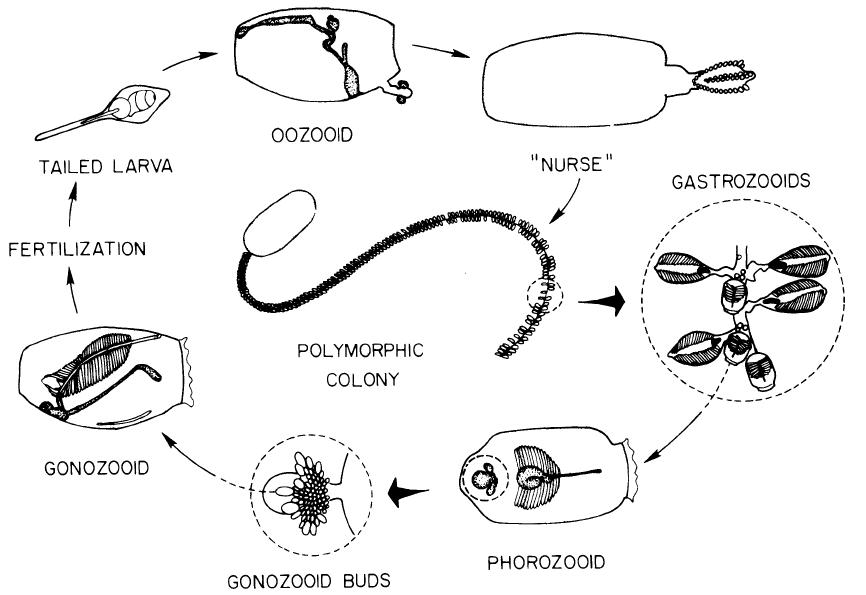
Dolioliden weisen einen ähnlichen Lebenszyklus auf, jedoch weisen sie polymorphe, asexuelle Individuen auf: die Phorozooiden und die Gastrozooiden (Abb. 5, Alldredge et al., 1982).
Das adulte, asexuelle Tier, Oozooid genannt, produziert Knospen. Diese Knospen verlassen, was einen Unterschied zu den Salpen darstellt, das Muttertier und wandern in Richtung des Tragfortsatzes. Abhängig von ihrer Position auf dem Tragfortsatz entwickeln sich die Knospen unterschiedlich. Lateral angeordnete Knospen entwickeln sich zu Trophozooiden, auch Gastrozooiden genannt, deren Aufgabe darin besteht, die gesamte Kolonie mit Nahrung zu versorgen. Median angeordnete Knospen werden Phorozooiden genannt und diese entwickeln die Urgeschlechtsknospen. Diese dienen der sexuellen Reproduktion. Die Phorozooiden lösen sich vom Tragefortsatz ab und entwickeln sich frei-schwimmend weiter, bis sich die an ihnen befindenden sexuellen Gonozooiden nach deren Reifung ablösen. Gonozooiden sind Hermaphroditen und die Fertilisation findet intern statt, diese konnte jedoch bislang nicht ausreichend dokumentiert werden. Nach der Befruchtung entsteht eine Larve, die der der Ascidien ähnlich ist, welche sich nach einer Metamorphose zu einem asexuellen Oozooiden entwickelt.
Gängige Modellorganismen aus der Klasse der Thaliaceen existieren nicht, da die Haltung dieser Tiere in Laboratorien schwer ist, Untersuchungen während der Embryonalentwicklung schwer durchführbar sind, da die Embryonen nur schwer zugänglich sind und bis dato keine etablierten Protokolle zur Untersuchung von Thaliaceen-Arten existieren.
4.3 Ascidiacea
Die größte und zugleich diverseste Klasse der Tunikaten stellt die Klasse der Ascidien mit bis derzeit etwa 3.000 beschriebenen Arten aus allen marinen Ökosystemen dar. 1886 unterteilte Lahille die Klasse der Ascidien anhand der Struktur des adulten Kiemendarmes in drei Unterordnungen (Abb. 6, Lahille, 1886):
1. Aplousobranchia: Pharynx ohne innere, longitudinal-verlaufende Gefäße oder Faltungen
2. Phlebobranchia: Pharynx mit inneren, longitudinal-verlaufenden Gefäßen jedoch ohne Faltungen
3. Stolidobranchia: Pharynx mit inneren, longitudinal-verlaufenden Gefäßen und mit Faltungen
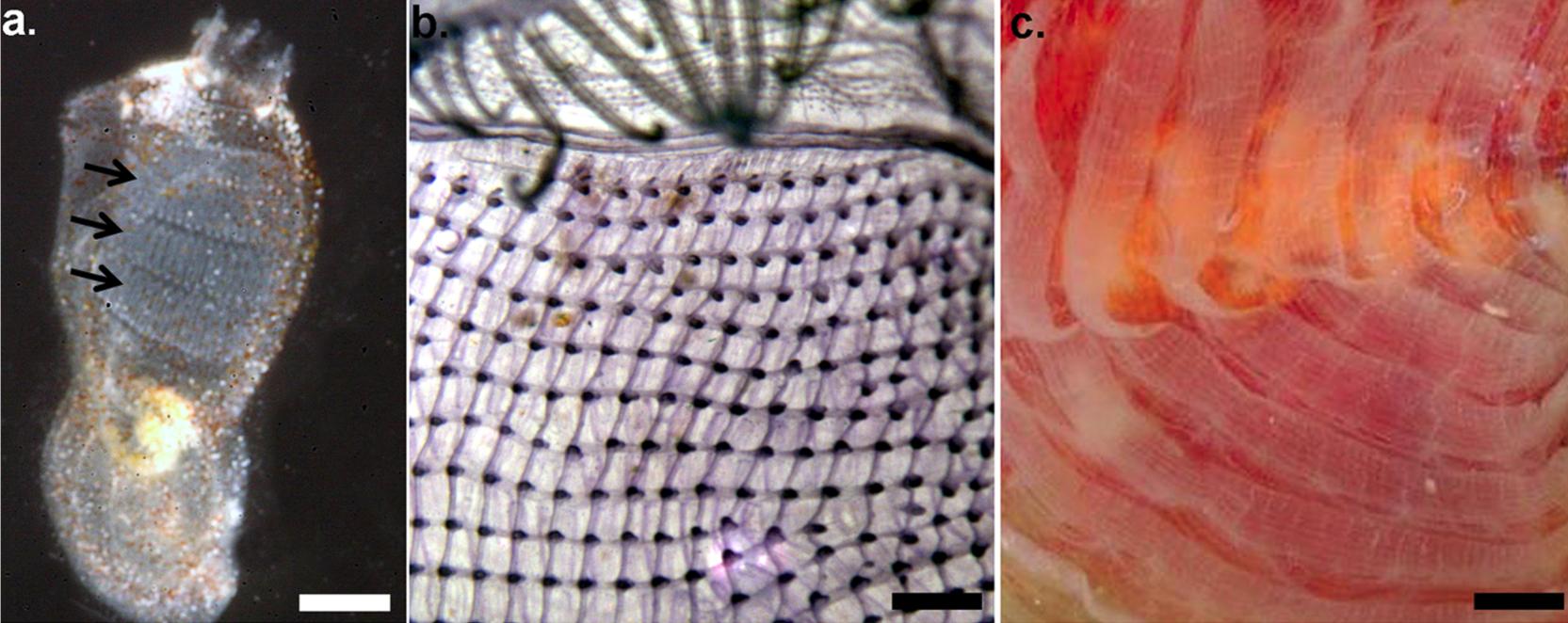
Abb. 6 Klassifizierung der Ascidien nach Lahille (1886) anhand der Struktur des adulten Kiemendarmes. a) Aplousobranchia: Pharynx ohne innere, longitudinal-verlaufende Gefäße oder Faltungen b) Phlebobranchia: Pharynx mit inneren, longitudinal-verlaufenden Gefäßen jedoch ohne Faltungen c) Stolidobranchia: Pharynx mit inneren, longitudinal-verlaufenden Gefäßen und mit Faltungen.
Shenkar und Swalla (2011) in Plos One
Weitere Klassifikationsmethoden existieren (Perrier, 1898), jedoch ist die Klassifikation von Lahille noch heute die bekannteste und von Taxonomen bevorzugte Methode zur Unterteilung der Ascidien. Molekular-physiologische Analysen auf Grundlage der 18S rDNA untermauern die von Lahille aufgestellte Klassifikation (Tsagkogeorga et al., 2009).
Nachdem die Ascidien-Larve ein geeignetes Substrat gefunden hat, heftet sich die Larve mit Hilfe von adhäsiven Papillen, welche sich am rostalen Ende der Larve befinden, an das Substrat. Infolgedessen treten einige Veränderungen auf: Strukturen wie Notochord, Muskeln und der Großteil des Nervensystems degenerieren im Zuge eines programmierten Zelltods. Die inneren Organe rotieren um 90°, Mund- bzw. Einströmöffnung zeigen nach oben, während der Atrialporus seitlich ausmündet. Mit dem Fortschreiten der Metamorphose entwickeln sich adulte Organe aus larvalen, undifferenzierten Strukturen wie beispielsweise das Herz aus ventralen, im Rumpf vorzufindenden Zellen oder der Kiemendarm und die Verdauungsorgane aus dem larvalen Endoderm (Lemaire et al., 2008).
Während Individuen der Aplousobranchia ausschließlich kolonial leben (mit Ausnahme der Gattung Ciona), sind bei Phlebobranchia und Stolidobranchia sowohl Kolonie-bildende, als auch solitär-lebende Arten bekannt.
Solitär-lebende Arten der Phlebobranchia und der Stolidobranchia sind in der Regel im Vergleich zu Kolonie-bildenden Arten größer. Sie weisen einen größeren Kiemendarm auf, welcher sie dazu befähigt, größere Mengen Wasser zu filtrieren. Ihr im Vergleich größerer Darm weist komplexere Verdauungsstrukturen auf. Zusätzlich entwickeln die meisten Arten zusätzliche Exkretionsorgane, wie etwa die Familie Molgulidae der Stolidobranchia, welche Nieren besitzt.
Ein weiteres Beispiel stellen die Gonaden dar, welche bei den meisten solitären Arten beträchtlich größer sind als bei Kolonie-bildenden Arten (Kürn et al., 2011).
Kolonie-bildende Arten entstehen nach Anheftung der Larve an ein Substrat durch Knospung. Die Individuen einer Kolonie sind meist klein und einfach gebaut. Beispiele dafür sind ein kleiner Kiemendarm und das Fehlen zusätzlicher Verdauungsstrukturen bzw. das Fehlen von Ausstülpungen des Darmes. Um die Kolonie zu vergrößern und einen Austausch des genetischen Materials zu gewährleisten, findet eine innere Befruchtung statt, wobei der heranwachsende Embryo zunächst im Inneren der Kolonie aufwächst und sich nach Verlassen der ursprünglichen Kolonie nicht weit von ihr ansiedelt und eine neue Kolonie bildet, was einen Gegensatz zu der externen Befruchtung der solitär-lebenden Arten darstellt, bei der die Larve weite Strecken zurücklegt, um ein geeignetes Substrat zu finden.
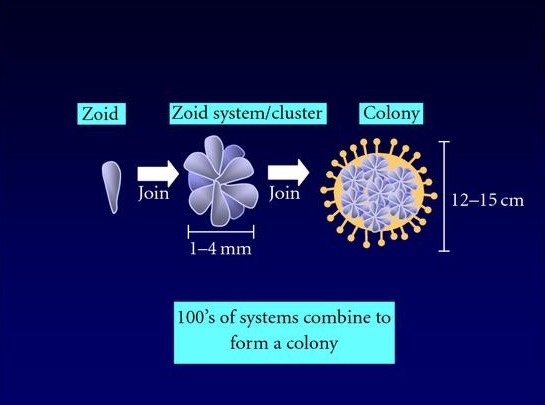
Abb. 7 Koloniebildung am Beispiel von Botryllus schlosseri.
Lightner et al. (2008) in Clinical & Developmental Immunology
Prominente Modellorganismen sind vordergründig solitär-lebende Arten wie Ciona intestinales oder Ciona savignyi, deren Genome inzwischen sequenziert sind und für die viele molekular-biologische Protokolle existieren. Das Genom der solitär-lebenden Art Phallusia mammillata ist zwar nicht sequenziert, diese Art bietet jedoch wegen der Produktion großer Zahlen an durchsichtigen Embryonen für Wissenschaftler experimentelle Möglichkeiten zur Untersuchung an Embryonen und an deren einzelnen Zellen.
Unter Kolonie-bildenden Arten finden sich nur wenige Modellorganismen. Dazu zählt Botryllus schlosseri, an dem Untersuchungen bezüglich der Blastogenese, der Verschmelzung mehrerer Kolonien und der Regeneration durchgeführt werden. Nach der Metamorphose setzt bei Kolonie-bildenden Arten ein lebenslanger Knospungsprozess ein, welcher zur Bildung einer Kolonie aus genetisch identischen Individuen führt. Die Individuen werden dabei in eine gemeinsame Tunika eingebettet. Dabei weisen einige Kolonie-bildende Arten sogar ein gemeinsames vaskuläres System außerhalb des eigentlichen Körpers auf.
Liegen zwei Ascidien-Kolonien in unmittelbarer Nähe zueinander, können sie durch das Wachsen der Kolonien aufeinander treffen. Dieses Ereignis führt zu einer Allorekognition an den terminalen Enden der Ampullae, wobei es sich um Strukturen im äußeren Bereich des extrakorporalen Gefäßsystems handelt. Das Phänomen ist besonders gut bei der kolonial lebenden Art Botryllus beschrieben. Nach dem Anheften der Botryllus-Larve an das Substrat und der Metamorphose zu einem Oozooid bildet sich durch die asexuelle Vermehrung eine Kolonie mit genetisch identischen Zooiden, welche sich so anordnen, dass eine Blumen-ähnliche Struktur entsteht. Aus einem Zooid können 1-4 Knospen entstehen. Nach dem Knospungsprozess stirbt der Zooid, wird durch Phagozyten aus dem vaskulären System verdaut und durch die neuen Knospen ersetzt (Abb. 7, De Tomaso, 2006; Lightner et al., 2008).
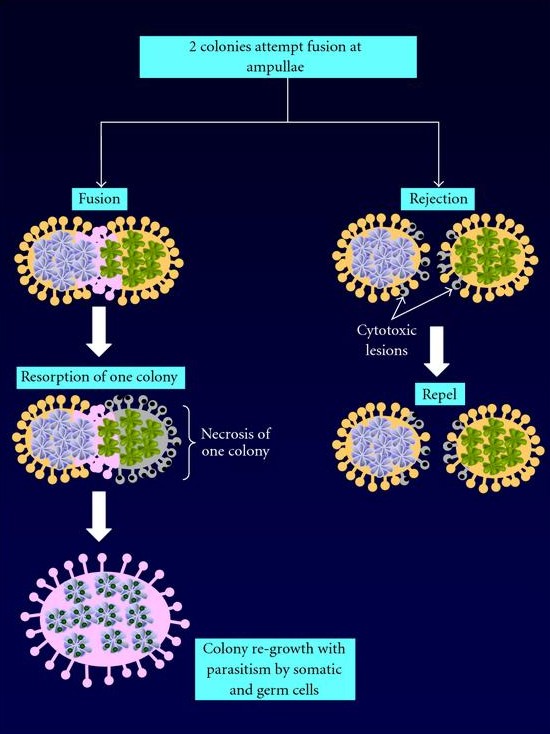
Abb. 8 Fusionierung/Allorekogniton zweier Botryllus Kolonien.
Lightner et al. (2008) in Clinical & Developmental Immunology
Treffen zwei Kolonien aufeinander, können sie mit Hilfe der Ampullae zwischen eigenem und fremdem Gewebe unterscheiden (Allorekogniton). Dieser Prozess wird durch einen einzelnen, polymorphen, co-dominant expremierten Locus, den Fusion-Histocompatibility (FuHC), gesteuert (De Tomaso, 2006; Lightner et al., 2008). Besitzen beide aufeinander treffende Kolonien eine oder beide FuHC Allele, können sie miteinander fusionieren. Besitzt eine Kolonie keine FuHC-Allele, findet eine Abstoßungsreaktion statt und eine Fusion findet nicht statt.
Untersuchungen an B. schlosseri ergaben, dass bis zu mehrere hundert FuHC-Allele in einer Population auftreten können. Fusionieren zwei Kolonien, bildet sich eine Chimäre, welche fortan das vaskuläre System beider Kolonien besitzt. Hypothetisch kann dieser Prozess von Vorteil sein, da eine Vergrößerung der Kolonien und des Gefäßsystems die Überlebenschancen erhöhen kann. Die genetische Diversität innerhalb einer größeren Kolonie kann auch vorteilhaft in einer sich verändernden Umgebung sein, auch was die Fortpflanzung und einen damit erleichterten Genaustausch angeht.
Jedoch zeigen Beobachtungen, dass eine solche Fusionierung eher Nachteilhaft für eine der beiden fusionierenden Kolonien ist. Untersuchungen zeigten, dass die Zooiden und die Knospen der einen Kolonie von Phagozyten der anderen Kolonie verdaut wurden, wodurch sich die gewinnende Kolonie der zusätzlichen Ressourcen, wie zum Beispiel dem Gefäßsystem, bemächtigte (Rinkevich und Yankelevich, 2004).
Darüber hinaus bietet das gemeinsame vaskuläre System Keimzellen und somatischen Zellen, welche für die Knospung essentiell sind, die Möglichkeit sich in der neuen Kolonie anzusiedeln. Dies kann dazu führen, dass die Zelllinie einer Kolonie überhandnimmt und die andere Partie teilweise oder auch vollständig ersetzt, was Auswirkungen auf den Phaenotyp haben kann (Abb. 8).
5 Ausblicke für die Zukunft
Lange Zeit konzentrierte sich die Forschung der Tunikaten auf die Entwicklung der Tunikaten-Embryonen und Tunikaten-Larven, da diese Stadien Anhaltspunkte für den gemeinsamen Vorfahren der Chordaten bieten. Mit der Sequenzierung des Genoms einiger ausgewählter Arten ist es nun jedoch möglich, über die Embryologie hinauszugehen. Erste Einblicke in das Genom zeigen, dass Tunikaten zu den Metazoen gehören, welche eine sehr schnelle Evolutionsrate besitzen (Denoeud et al., 2010). Durch weitere Modellorganismen aus dem Unterstamm der Tunikaten könnten weitere neue Erkenntnisse über die endgültige Systematik, sowohl was die innere Systematik als auch was ihre Stellung unter den Chordaten angeht, gewonnen werden.
6 Literatur
Alldredge A. 1976. Appendicularians, Scientific American, 235: 94-102.
Alldredge A, Madin L. 1982. Pelagic tunicates: Unique herbivores in the marine plankton. Bioscience 32. 655-663.
Chabry L. 1887. Contribution a l’embryologie normale tératologique des ascidies simples. Journal de l’anatomie et de la physiologie 23: 167-321.
Conklin E. 1905. The orientation and cell-lineage of the ascidian egg. ournal of the Academy of Natural Sciences of Philadelphia 13: 5-119.
De Tomaso A. 2006. Allorecognition polymorphism versus parasitic stem cells. Trends in Genet 22: 485-490.
Denoeud F, Henriet S, Mungpakde, S, Aury J, Da Silva C, Brinkmann H, Mikhaleva, J, Olsen L., Jubin C, Cañestro C. 2010. Plasticity of animal genome architecture unmasked by rapid evolution of a pelagic tunicate. Science 330: 1381-1385.
Edverdsen R., Lerat E, Maeland A. 2004. Hypervariable and highly divergent intron-exon organizations in the chordate Oikopleura dioica. Journal of Molecular Evolution 59: 448-457.
Fenaux R. 1993. The classification of Appendicularia (Tunicata); history and current state. Memoires de l’Institut Oceanographique, Monaco 17: 1-123.
Kott P. 1985. The Australian Ascidiacea Pt 1, Phlebobranchia and Stolidobranchia. Memoirs of the Queensland Museum 23: 1-440.
Kuern U, Rendulic S, Tiozzo S, Lauzon RJ. 2011. Asexual Propagation and Regeneration in Colonial Ascidians. Biological Bulletin 221: 43-61.
Lahille F. 1886. Sur la classification des Tuniciers. Comptes-rendus de l’Académie des Sciences de Paris 102: 1573-1575.
Lemaire P. 2011. Evolutionary crossroads in developmental biology: the tunicates. Development 138: 2143-2152.
Lemaire P, Smith WC, Nishida H. 2008. Ascidians and the plasticity of the chordate developmental program. Current Biology 18: R620-R631.
Lightner A, Schust D, Chen Y, Barrier B. 2008. The fetal allograft revisited: does the study of an ancient invertebrate species shed light on the role of natural killer cells at the maternal-fetal interface? Clinical & Developmental Immunology. vol. 2008, Article ID 631920, 10 pages.
Munro E, Robin F, Lemaire P. 2006. Cellular morphogenesis in ascidians: how to shape a simple tadpole. Current Opinion in Genetics and Development 16(4): 399-405.
Perrier J. 1898. Note sur la classification des Tuniciers. Comptes-rendus de l’Académie des Sciences de Paris 126: 1758-1762.
Rinkevich B. Yankelevich I. 2004. Environmental split between germ cell parasitism and somatic cell synergism in chimeras of a colonial Urochordate. Journal of Experimental Biology 207: 3531-3536.
Seo H, Kube M, Edvardsen R, Jensen M, Beck A, Spriet E, Gorsky G, Thompson E, Lehrach H, Reinhardt R, Chourrout D. 2001. Miniature genome in the marine chordate Oikopleura dioica. Science 294: 2506.
Shenkar N, Swalla B. 2011. Global Diversity of Ascidiacea. Plos One 6(6): e20657.
Tohme R, Darwiche N, Gali-Muhtasib H. 2011. A Journey Under the Sea: The Quest for Marine Anti-Cancer Alkaloids. Molecules 16: 9665-9696.
Tsagkogeorga G, Turon X, Hopcroft R, Tilak M, Feldstein T. 2009. An updated 18S rRNA phylogeny of tunicates based on mixture and secondary structure models. BMC Evolutionary Biology 9: 187.
Wolpert L. 1999. Entwicklungsbiologie, Spektrum Akademischer Verlag, Heidelberg.
[printfriendly]