1 Echinodermata – ein kurzer Überblick
Echinodermaten (aus dem griechischem „echinos“ für Igel und „derma“ für Haut) gehören neben den Chordaten zu den Deuterostomiern. Echinodermaten kommen allerdings ausschließlich marin vor und bis auf wenige bathypelagische Arten der Seegurken sind sie vordergründig im Benthos des Schelfs und der bathyalen Meeresböden beheimatet. Sogar einige hadal-lebende Spezies konnten entdeckt werden. Etwa 6.500 rezente Arten sind derzeit bekannt, welche in 5 Klassen eingeordnet werden:
1. Crinoidea (Seelilien und Haarsterne)
2. Asteroidea (Seesterne)
3. Ophiuroidea (Schlangensterne und Medusenhäupter)
4. Holothuroidea (Seegurken)
5. Echinoidea (Seeigel)
Dabei werden die festsitzenden, primär gestielten Crinoidea als eine Schwestergruppe der Eleutherozoa, bestehend aus den freibeweglichen Arten der Asteroidea, Ophiuroidea, Holothuroidea und Echinoidea mit einer Achse durch den oralen-aboralen Punkt, angesehen. Diese Verwandtschaftsbeziehung innerhalb der Echinodermaten ist nicht unumstritten, da andere Perspektiven existieren, die beispielsweise von einer engeren Verwandtschaftsbeziehung der Crinoidea mit den Asteroidea und den Ophiuroidea ausgehen.
Trotz der großen Anzahl an Fossilienfunden (etwa 13.000), welche eine Existenz der Echinodermaten ab dem frühen Kambrium belegen, bleibt deren taxonomische Herkunft innerhalb der Deuterostomia unklar. Verschiedene Szenarien existieren, bei denen die Echinodermaten unterschiedliche Positionen innerhalb der Deuterostomier einnehmen, wobei vordergründig ihre Verwandtschaft zu den Hemichordaten und den Chordaten/Tunikaten debattiert wird.
Echinodermaten besitzen für ihr Taxon charakteristische Merkmale, welche sie von anderen Taxa deutlich abhebt. Zu diesen Merkmalen gehört das Ambulacralgefäßsystem, welches wichtige Aufgaben bei der Fortbewegung, der Nahrungsaufnahme, der Atmung, der Exkretion und der Reizaufnahme übernimmt, sowie die fünfstrahlige bzw. pentamere Symmetrie der adulten Tiere, deren Hauptachse durch den Mund bzw. durch den After verläuft.
Die Entwicklung der getrenntgeschlechtlichen Echinodermaten beginnt mit der äußeren Befruchtung der Eizelle und ihrer anschließenden Furchung bis zur Bildung einer frei-schwimmenden, planktonisch-lebenden, bilateral symmetrischen Larve. Diese entwickelt sich daraufhin im Zuge einer Metamorphose zur adulten Form, wobei die typische pentamere Radiärsymmetrie ausgebildet wird.
An Embryonen und Larven von Echinodermaten wurden in der Naturwissenschaft unterschiedliche und vielseitige Experimente durchgeführt, durch deren Ergebnisse beispielsweise die Entwicklungsbiologie und die Immunologie profitierten. Während lange Zeit angenommen wurde, Invertebraten seien nicht im Besitz eines Immunsystems, konnte Metchnikoff bereits 1893 Prozesse wie die Abstoßung von Fremdkörpern und Phagozytose in der Larve der Astropecten pentacanthus nachweisen.
Wegen ihrer Zugehörigkeit zu den Deuterostomiern und ihrer damit näheren Verwandtschaft zu den Chordaten weckte die Entwicklung der Echinodermaten und die Regulation der Embryonalentwicklung auf genetischer Ebene in der Entwicklungsbiologie besonderes Interesse.
Zur Untersuchung dieser Aspekte bieten Echinodermaten einige Vorteile. Seeigel, die Hauptmodellorganismen der Echinodermaten in der Entwicklungsbiologie, produzieren eine große Anzahl an Eizellen, welche im Wasser befruchtet werden.
Die enorme Anzahl an möglichen befruchteten Eizellen ermöglicht es im Idealfall alle Stadien der Embryonal-/Larvalentwicklung unter anderem für molekular-biochemische Prozesse zu studieren, da mit molekularen und zellulären Methoden leicht in ihre Entwicklung eingegriffen werden kann. Das Vorhandensein gut entwickelter Methoden zur Herstellung transgener Individuen, zur Durchführung von Morpholino-Injektionen und das Vorhandensein von RNAi-Protokollen macht sie in der (marinen) Entwicklungsbiologie zu beliebten Modellorganismen.
2 Furchung der Echinodermaten am Beispiel des Seeigels
Besonders intensiv untersucht wurde die frühe Entwicklung der Seeigel. Seeigel weisen dabei eine radiale, holoblastische Furchung auf, wobei die ersten sieben Furchungen stereotypisch, d.h. in allen Individuen derselben Art identisch, verlaufen.
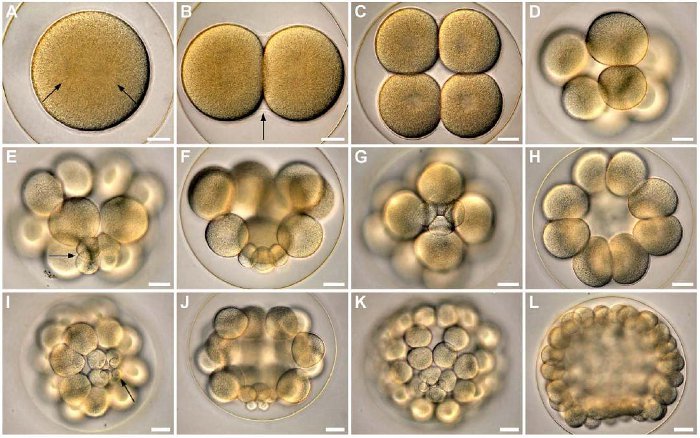
Abb. 1 Frühe Furchung am Beispiel des Sanddollars Clypeaster subdepressus. Vellutin und Migotto, 2010, PLoS ONE.
Lizenz: Creative Commons Attribution License
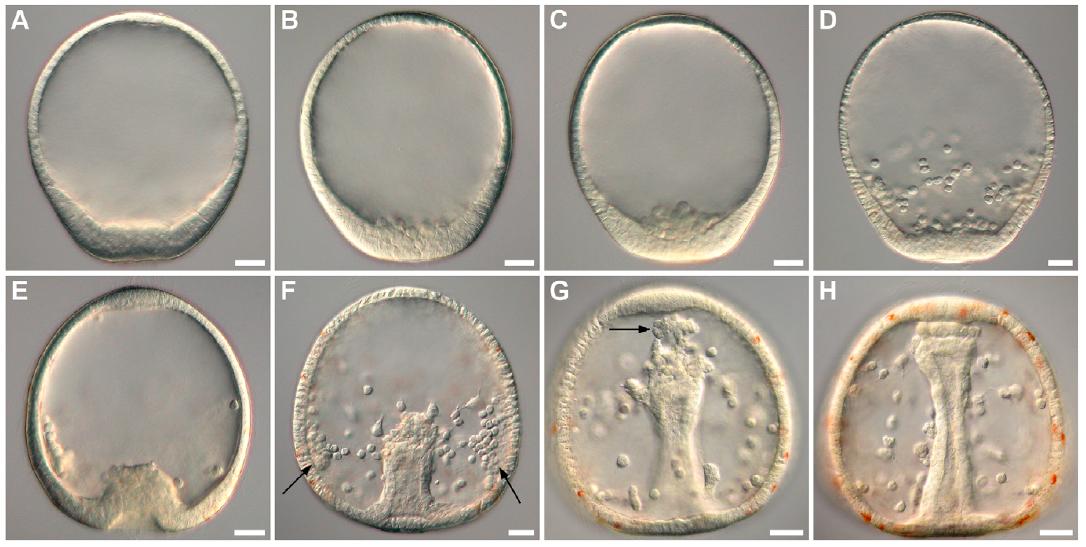
Abb. 2 Gastrulation am Beispiel des Sanddollars Clypeaster subdepressus. Vellutin und Migotto, 2010, PLoS ONE.
Lizenz: Creative Commons Attribution License
Während der ersten beiden Furchungen teilt sich die befruchtete Eizelle entlang der animal-vegetativen Achse, d.h. meridional, jeweils um 90° gegeneinander versetzt (Abb. 1). Die dritte, äquatoriale Furchung unterteilt den Embryo in eine animale und einer vegetale Hemisphäre. Die vierte Teilung der Seeigel-Embryonen verläuft bei der animalen Hälfte meridional. Die vegetale Hälfte teilt sich äquatorial und inäqual. Währen die vier Zellen in der animalen Hälfte, auch als Mesomere bezeichnet, in etwa gleich groß sind, finden sich auf der vegetalen Hälfte, durch die inäquale Teilung, vier große Makromeren und vier kleine Mikromeren.
Die nächste Teilung verläuft bei den Mesomeren äquatorial, wobei die neu entstandenen 16 Zellen sich in 2 übereinander gelegenen Reihen anordnen. Die Makromeren teilen sich hingegen meridional, die Mikromeren mit einer Verzögerung wieder inäqual. Nach einer wiederholten Teilung der Mikromeren am vegetalen Pol findet bis zum Larvenstadium keine Teilung der Mikromeren mehr statt.
Bei der sechsten und siebten Teilung wechseln sich meridionale und äquatoriale Teilungen der Mesomeren und Makromeren ab. Erreicht der Embryo das 120-Zellstadium bzw. das Blastulastadium, kommt es zur Bildung eines zentralen Hohlraumes, dem Blastocoel, welches von einer Zellschicht aus gleich großen Zellen umgeben ist. Weitere Teilungen führen zu einer Verdünnung der Zellen dieser Zellschicht.
Nach der neunten oder zehnten Furchung tragen die einzelnen Zellen an der Außenseite Cilien. Anschließend schlüpft die Blastula aus der Eihülle, indem sie Verdauungsenzyme sezerniert, welche die Eihülle enzymatisch abbauen. Es folgt die Gastrulation, wobei sich die Zellen nun durch eine Wanderung die Positionen begeben, die für die zukünftige Wanderung der Zellen und die Ausbildung der aus ihnen entstehenden Gewebe vorgesehen sind. Die zukünftigen Endoderm- und Mesodermzellen befinden sich am vegetativen Pol, die Mesoderm-bildenden Zellen liegen dabei an der polarsten vegetativen Position und von den Endoderm-bildenden Zellen umgeben sind, während die übrigen Zellen das zukünftige Ektoderm bilden.
Die Gastrulation beginnt mit der Umwandlung der Mesoderm-bildenden Zellen, welche aus Mikromeren entstanden, zu primären Mesenchymzellen. Sie dissoziieren voneinander und wandern unabhängig voneinander in das Blastocoel, wo sie an spezifischen Stellen der Blastula entlang wandern bis sie in der ventro-lateralen Region des Blastocoels zum Stillstand kommen (Abb. 2).
Danach folgt die Invagination der Endodermzellschicht, wodurch sich an der Stelle der Einstülpung der Blastoporus bildet. Erreicht die eingestülpte Endodermzellschicht etwa die Hälfte des Blastocoels, wandeln sich die am weitesten im inneren des Blastocoels gelegenen Zellen des eingestülpten Endoderms so um, dass sie Filopodien entwickeln, welche mit der Innenfläche der Blastocoelwand in Kontakt treten können. Sie bilden das sekundäre Mesenchym. Dieser Prozess ermöglicht es dem eingestülpten Endoderm durch die wiederholte Anheftung der Filopodien an die Innenwand und deren Kontraktion entlang der Blastocoelwand sich weiter einzustülpen, bis es auf der ventral-gelegenen Seite auf die künftige Mundregion trifft und diese durchbricht. Danach verteilen sich die Zellen des sekundären Mesenchyms im Blastocoel, wo sie die mesodermalen Organe sowie Muskel- und Pigmentzellen bilden.
Urheber: Bruno C. Vellutini
Lizenz: Creative Commons Attribution-Share Alike 3.0 Unported
Die Originaldatei ist hier zu finden.
3 Echinodermaten besitzen verschiedene Larvenformen
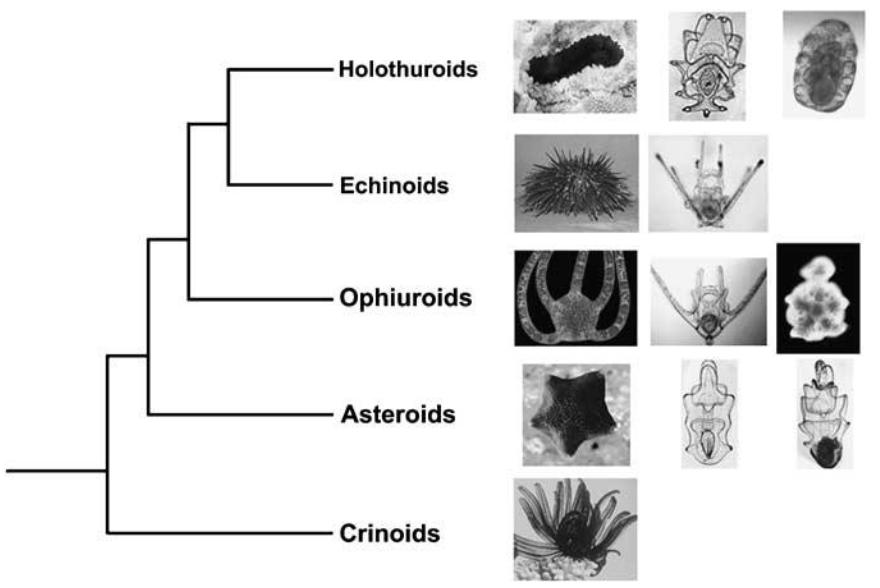
Abb. 3 Typische Larvenformen der unterschiedlichen Klassen der Echinodermaten. Raff und Byrne, 2006.
(c) Reprinted by permission from Macmillan Publishers Ltd: [Heredity] (Raff RA, Byrne M. 2006. The active evolutionary lives of echinoderm larvae. Heredity 97: 244-252.), copyright (2006)
Am Ende der Embryonalentwicklung ist die bilateralsymmetrische Larve eines Echinodermaten entstanden, welche bei unterschiedlichen Klassen verschiedene Formen besitzt und sogar innerhalb einer Klasse eine unterschiedliche Entwicklung aufweisen kann, was abhängig vom Dottergehalt der Eizelle geschieht.
Larven, welche aus einer dotterarmen Eizelle hervorgegangen sind, leben planktotroph, d.h. sie ernähren sich im frei-schwimmenden Larvenstadium ausschließlich von Planktonorganismen. Larven, die sich hingegen aus einer dotterreichen Eizelle entwickelt haben, besitzen eine lecithotrophe Ernährungsweise. Sie besitzen keinen Darm und ernähren sich vom Dotterreservoir der Eizelle.
Mit Ausnahme der Crinoidea existieren in allen Klassen sowohl Vertreter mit planktotroph- als auch Vertreter mit lecithotroph-lebenden Larven. Crinoidea bilden ausschließlich lecithotroph-lebende Larven, aus denen sich die adulten Formen direkt entwickeln. Es wird vermutet, dass das Vorhandensein von ausschließlich lecithotroph-lebenden Larven auf das Perm-Trias-Ereignis, bei dem es sich um ein Massensterben am Übergang zwischen Perm und Trias handelt, als bottleneck zurückzuführen ist und sich die Crinoidea infolgedessen aus einer einzelnen Tierart mit rein lecithrotroph-lebenden Larven entwickelt haben.
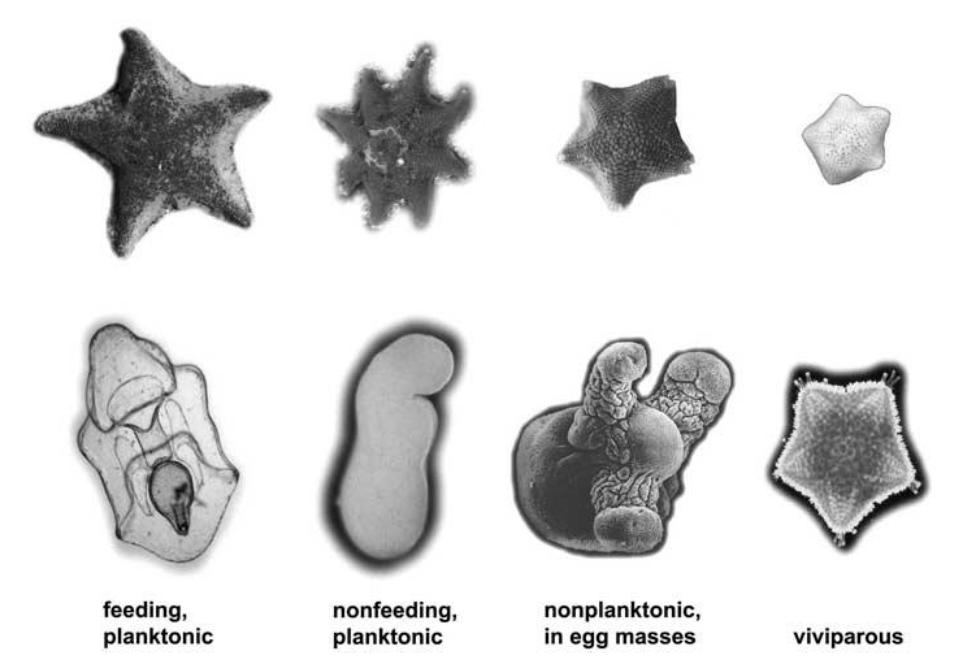
Abb. 4 Variabilität der Larvenformen innerhalb der Asteroidea aufgrund unterschiedlicher Lebensweise der Larven. Raff und Byrne, 2006.
(c) Reprinted by permission from Macmillan Publishers Ltd: [Heredity] (Raff RA, Byrne M. 2006. The active evolutionary lives of echinoderm larvae. Heredity 97: 244-252.), copyright (2006)
Trotz der Formenvielfalt der Larven kann von einer grundlegenden, hypothetischen Larvenform der Echinodermaten ausgegangen werden, welche bilateral symmetrisch ist und die um den ventral-gelegenen Mund ein Wimpernband trägt (Abb. 3).
Die Larven der Echinoidea und der Ophiuroidea haben infolge der pelagischen Lebensweise eine äußerlich ähnliche Larvenform, deren Gestalt als Plutei-Larve bezeichnet wird. Beide Larvenformen besitzen Schwebefortsätze, welche von Skelettstäben gestützt werden. Die Schwebefortsätze der Echinoidea-Larve, auch Echinopluteus genannt, stehen allerdings enger zueinander als die Schwebefortsätze der Ophiuroidea-Larve, auch Ophiopluteus genannt. Das Cilienband folgt den Konturen der Schwebefortsätze. Bei einigen Arten der Ophiuroidea durchläuft die Ophiopluteus eine Metamorphose, aus der die sogenannte Vitellaria-Larve hervorgeht.
Larven von Seegurken weisen zwei Stadien auf. Die frühe Larve, die sogenannte Auricularia-Larve, besitzt einen Wimpernband, welches über viele Lappen hinwegläuft. Das zweite Stadium wird durch eine Metamorphose eingeleitet, aus der die zweite Larvenform, die Doliolaria-Larve, hervorgeht. Das Wimpernband wird dabei durch 3-5 Cilienringe ersetzt. Die Doliolaria-Larve nimmt keine Nahrung auf und entwickelt sich später zu der juvenilen Form der Seegurke weiter. Einige Arten der Holothuroidea besitzen keine Auricularia-Larven, sondern entwickeln sich direkt aus der Doliolaria-Larve in die juvenile Form.
Die Asteroidea-Larve, die Bipinnaria-Larve, besitzt zwei um den Körper geschlungene Cilienbänder. Die Bipinnaria-Larve entwickelt sich im Zuge einer Metamorphose zu einer Brachiolaria-Larve weiter, welche apikal drei Haftarme und eine Haftscheibe ausbildet, um sich an ein Substrat festsetzen zu können und dort die Metamorphose zur adulten Form zu vollziehen.
Einige Arten der Ordnung Paxillosida besitzen lecithotroph-lebende Larven, welche nicht die typische Bipinnaria-Larvenform besitzen, sondern stattdessen direkt die Form einer Brachiolaria-Larve annehmen. Das Aussehen der Brachiolaria-Larve kann sehr divers sein, abhängig vom Ort der Entwicklung (im Plankton, im Benthos, im Muttertier etc.) und der Lebens-bzw. der Ernährungsweise (Abb. 4).
4 Hohes Regenerationspotential der Echinodermaten

Abb. 5 Fortpflanzung durch Regeneration eines vollständigen Individuums aus einem einzelnen Arm bei Asteroidea.
Foto: Emöke Dénes
Lizenz: Creative Commons Attribution-Share Alike 2.5 Generic
Die Originaldatei ist hier zu finden.
Ein Potential, das alle Echinodermaten gemein haben, ist ihr hohes Regenerationspotential. Aufgrund dessen waren Echinodermaten bereits früh im 19. Jahrhundert beliebte Modellorganismen für die Erforschung der Regeneration. Im frühen 20. Jahrhundert gerieten Echinodermaten als Modellorganismen jedoch zunehmend in Vergessenheit, bis sie Anfang des 21. Jahrhunderts wieder auf ihre Regenerationsfähigkeit und ihr damit zusammenhängendes Potential als Modellorganismen zu dienen untersucht wurden.
Die hohe Regenerationsfähigkeit von Echinodermaten betrifft sowohl ihre Larvenstadien, als auch die adulten Tiere (Eaves und Palmer, 2003), und reicht bei adulten Tieren von der Regeneration von Gliedmaßen, über die Regeneration der Eingeweide, bis hin zur Regeneration von ganzen Tieren aus abgetrennten Gliedmaßen bei Asteroidea (Abb. 5).
Dabei ist der Verlust der Körperteile oft auf Autotomie in Form eines selbst induzierten Abwerfens der Körperteile zur Abwehr von Fressfeinden zurückzuführen. Als Beispiele hierfür sind das Ausstoßen der Eingeweide bei Holothuroidea oder das Abschnüren von Körperteilen bei Asteroidea und Ophiuroidea zu nennen. Die anschließende Regeneration der Eingeweide bei ausgeweideten Holothuroidea, die Regeneration abgeschnürter Arme bei Ophiuroidea und Asteroidea sowie die Regeneration vollständiger Individuen aus den abgeschnürten Armen von Asteroidea verdeutlicht wie groß das Regenerationspotential bei Echinodermaten ist.
5 Besondere anatomische Merkmale heben die Echinodermaten von anderen Tieren ab
Echinodermaten besitzen eine oft bewimperte Epidermis mit einer darunterliegenden mesodermalen, bindegewebsartigen Dermis. In diese Dermis eingelagert befindet sich das aus Calciumcarbonat bestehende Endoskelett. Das Endoskelett liegt in Form von Platten (Ambulakralplatten) in der Dermis vor. Die von Bindegewebezellen gebildeten Platten können isoliert voneinander vorliegen, oder aber miteinander fusionieren, sodass eine Panzerung entsteht, deren Beweglichkeit stark variieren kann. Die namensgebenden Stacheln gehören ebenfalls zu dem Endoskelett, kommen aber nicht bei allen Arten der Echinodermaten vor. Stacheln sitzen auf den Gelenkhöckern der Skelettplatten, sind von der Epidermis überzogen und können mit Hilfe von Muskeln bewegt werden.
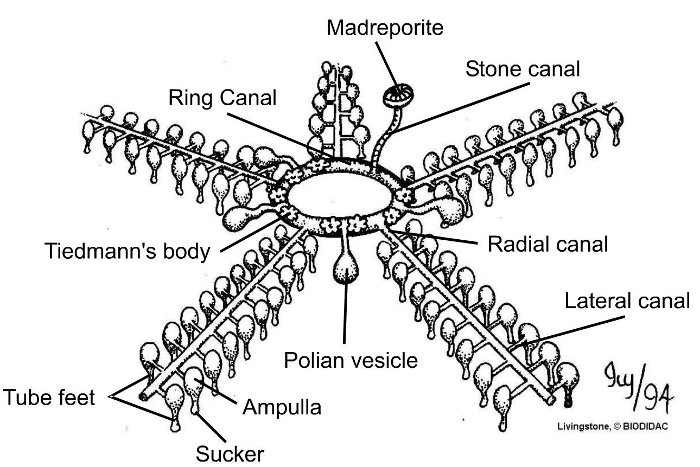
Ein weiteres Charakteristikum der adulten Echinodermaten ist das komplexe Coelom, welches aus drei miteinander verbundenen Strukturen besteht (Abb. 6).
Die erste Struktur umgibt in Form eines Ringkanals die Mundöffnung und besitzt mehrere sogenannte Poli’sche Blasen. Vom Ringkanal aus entspringt ein verkalkter Steinkanal. Dieser Steinkanal steht mit der siebartigen Madreporenplatte, welche an die Körperoberfläche angrenzt, in Verbindung und aufgrund dieser siebartigen Struktur auch mit dem Meerwasser. Des Weiteren gehen fünf Radiärkanäle, sogenannte Ambulakrale, vom Ringkanal ab. Diese Ambulakralen treten in tentakelartige, bewegliche Hautschläuche ein, welche als Fortbewegungsorgane, auch Ambulakralfüßchen genannt, dienen können. Bei Crinoiden können sie aber auch als Fühler oder für die Nahrungsaufnahme eingesetzt werden. Dieses System aus Meerwasser gefüllten Kanälen wird auch als Ambulakralsystem bzw. Wassergefäßsystem bezeichnet.
Das Blutgefäßsystem verläuft in Form von sogenannten Lakunen, bei denen es sich um Hohlräume zwischen benachbarten Coelomkanälen handelt. Es besitzt kein eigenes Blutgefäßepithel und verläuft entlang des Ambulakralsystems und auch entlang des Darmes.
Spezifische Atmungsorgane kommen bei Echinodermaten nicht vor. Die Atmung erfolgt überwiegend über die Haut und das Ambulakralsystem, was dieses zu einem besonders vielfältigen Organ macht. Kiemenbüschel bei Seeigeln oder Kiementaschen im Bereich des Mundfeldes bei Schlangensternen kommen aber auch vor und können die Atmung unterstützen.
Trotz eines zentralen Nervenringes (bei Seesternen und Seeigeln) kann dieser nicht als ein Zentralorgan des Nervensystems bezeichnet werden. Trotz einer auffallenden Strukturierung im Nervensystem besitzt es auch große dezentral wirkende anteile, so befinden sich Zellkörper von Nervenzellen, sogenannte Perikaryen, und Fortsätze der Nervenzellen zwischen allen Epithelien der Coelome sowie in der Epidermis und im Endoderm und liegen dort geflechtartig verzweigt vor. Bei einigen Arten und speziell bei den Crinoidea befinden sich auch im Bereich des Bindegewebes Teile des Nervensystems.
Die auffallende Strukturierung führte bereits früh zu einer Unterteilung des Nervensystems in 3 Abteilungen, welche das Nervensystem in einen Anteil ectoneurales und einen Anteil hyponeurales Nervensystem unterteilen, sowie einen Anteil apikales bzw. aborales Nervensystem, welches Teil des hyponeuralen Nervensystems ist. Der ectoneurale Anteil besteht aus einem Nervenring um den Mund herum und den sich in die Arme erstreckenden Nerven, soweit Arme vorhanden sind. Der hyponeurale Anteil befindet sich in der Regel in der großen allgemeinen Leibeshöhle und ist rein motorisch. Als aboraler Anteil des Nervensystems wird der Anteil des hyponeuralen Nervensystems bezeichnet, welcher aboral gelegene Körperregionen wie die Gonaden versorgt.
6 Die Klassen
6.1 Crinoidea

Abb. 7 Eine Seelilie.
Foto: NURC/UNCW und NOAA/FGBNMS
Lizenz: public domain
Die Originaldatei ist hier zu finden.
Die rezent lebenden Arten der Crinoidea bilden mit 620 Arten die kleinste Klasse der Echinodermaten, wohingegen Fossilienfunde rund 6.000 Arten belegen.
Da Crinoiden Suspensionsfresser sind und die Nahrungsaufnahme durch Filtration erfolgt, sind sie vorwiegend in Bereichen des Meeres vorzufinden, in denen eine Wasserströmung ihnen den Nahrungserwerb ermöglicht (Abb. 7). Eine Besonderheit dieser Klasse stellen die Pinnulae dar. Hierbei handelt es sich um fingerförmige Anhänge auf den Armen der Crinoiden, welche durch Skelettelemente im Inneren der Arme gestützt werden. Ihre Funktion besteht in dem Betasten der Nahrung. Zusätzliche proximal-gelegene Pinnulae tragen außerdem die Gonaden.
Nach der Befruchtung und Entwicklung des Embryos entsteht eine Doliolaria-Larve mit einem apikalen Wimpernschopf und 4-5 Cilienringe. Nachdem die Doliolaria-Larve ein passendes Substrat gefunden hat und sich daran anheftet, entwickelt sie sich zu einem sogenannten Cyctid, welcher alle Cilien verliert. Es folgt die Bildung eines Stiels, die Entwicklung von Skelettplatten und Tentakeln mit Mund und After. Dieses Stadium wird als Pentacrinus-Stadium bezeichnet, welches einer Seelilie ähnelt. Nach einigen Monaten löst sich der Kelch vom Stiel und lebt fortan als ein freilebender Haarstern.
6.2 Asteroidea

Abb. 10 Der Lincks Walzenseestern Protoreaster linckii.
Foto: Arpingstone
Lizenz: public domain
Die Originaldatei ist hier zu finden.
Die zweitgrößte Klasse der Echinodermaten stellen die Asteroiden dar. Die typische Gestalt eines Asteroidens ist ein fünfarmiger Stern, deren Arme zu den Spitzen hin dünner werden (Abb. 8). Jedoch sind Arten mit vier bis sieben Armen bekannt. Die Anzahl der Arme des Sonnensterns (Solasteridae) hängt vom Alter ab. Auf der Oberseite befinden sich Stacheln, einige Arten besitzen auch Greifzangen, welche der Reinigung und dem Nahrungserwerb dienen. Auf der Unterseite befinden sich für die Fortbewegung notwendige hydraulisch bewegliche Saugfüßchen. Die Mundöffnung der Asteroidea liegt aus der Unterseite, der After falls vorhanden demgegenüber. Besitzen einige Arten keinen After, werden Nahrungsreste durch den Mund ausgestoßen. Viele Asteroiden sind Räuber. Die Nahrungsaufnahme erfolgt entweder im inneren des Darms, wobei einige Arten ganze Tiere in ihrem Inneren aufnehmen können, die Verdauung kann aber auch extraintestinal durch Ausstülpung des Magens erfolgen. Diese Methode wird vor allem bei dem vielen spezialisierten Muschelfresser eingesetzt, um in das Innere der geschlossenen Muschel zu gelangen.
6.3 Ophiuroidea

Abb. 9 Der Olivgrüner Schlangenstern Ophiarachna incrassata.
Foto: Neil
Lizenz: Creative Commons Attribution-ShareAlike 3.0
Die Originaldatei ist hier zu finden.
Die größte Klasse der rezent lebenden Arten der Echiodermaten stellen die Ophiuroidea dar (Abb. 9).
Meist besitzen die Arten fünf langgestreckte schlanke Arme, seltener bis zu acht Armen, welche sehr beweglich sein können. In das Innere der Arme sind zu „Wirbeln“ verwachsene Ambulakralplatten eingebettet, welche mit kräftigen Längsmuskeln verbunden sind und mit deren Hilfe die Armbewegungen in sämtlichen Richtungen ermöglicht wird. Die Länge der auf den Armen sich befindende Stacheln kann variieren. Es wird oft beobachtet, dass Arten mit langen Stacheln Filtrierer und Arten mit kurzen Stacheln Räuber sind.
6.4 Holothuroidea

Abb. 10 Die Königsseegurke Stichopus regalis.
Foto: Cubanito
Lizenz: public domain
Die Originaldatei ist hier zu finden.
Die Holothuroidea haben eine Körperform, welche entfernt an eine Gurke erinnert, wodurch sich ihr deutscher Name „Seegurke“ ergibt (Abb. 10).
Die typische Pentamersymmetrie der Echinodermaten lässt sich bei Holothuroiden kaum noch erkennen, da sie durch eine sekundäre bilateralsymmetrie fast gänzlich überlagert wird. Eine Ausnahme bilden die Ambulacralfüßchen der Holothuroidea, welche sich in Form von 5 Radien entlang des Körpers von der Mundregion in Richtung des Afters ziehen, woran sich die pentamere Symmetrie erkennen lässt.
Im Bereich des Mundes lässt sich eine große Zahl an Tentakeln erkennen, welche dem Nahrungserwerb dienen und homolog zu den Mundfüßchen der Seeigel sind.
Ein Merkmal der Holothuroidea sind außerdem die sogenannten Cuvier-Organe, bei denen es sich um in den Enddarm mündende Schläuche handelt, welche bei Gefahr durch den After ausgestoßen werden können. Ein je nach Art klebriges oder giftiges Sekret dient dabei der Verteidigung.
Neben diesen Cuvier-Organen können Holothuroidea auch alle anderen inneren Organe durch den After ausstoßen. Auch dieses Phänomen hat eine Funktion bei der Verteidigung gegen Freßfeinde, jedoch ist es bislang ungeklärt, ob es weitere Funktionen besitzt und einige Arten stoßen auch ohne Gefahr regelmäßig vor Winterbeginn ihre Organe aus. Die Regeneration der Organe dauert anschließend zwischen neun Tagen und sechs Wochen und stellt eine große Anstrengung für die Tiere dar.
6.5 Echinoidea

Abb. 11 Der Seeigel Echinus melo.
Foto: Marco Busdraghi
Lizenz: Creative Commons Attribution 3.0 Unported
Die Originaldatei ist hier zu finden.
Die Echinoidea, welche meist in den oberen Schelfmeeren vorzufinden sind, werden in die fünstrahligen „Regularia“ und die sekundär bilateralsymmetrischen „Irregularia“ unterteilt (Abb. 11).
Die Ambulacralplatten der „Regularia“ formen sich zu einem runden Skelett, auch Corona genannt, dessen Form bzw. Anordnung der Platten wichtige Hinweise zur Taxonomie liefern. Die durch Muskeln beweglichen Stacheln sitzen auf den Gelenkhöckern der Skelettplatten und dienen der Fortbewegung, der Bohrung bzw. der Grabung und der Abwehr. Um den Mund befinden sich sogenannte Pedicellarien, welche oft mit Giftdrüsen in Verbindung stehen und der Reinigung sowie der Nahrungsaufnahme dienen. Der Mund, welcher nach unten gerichtet ist, besitzt einer der im Tierreich kompliziertesten Kauapparat, die Laterne des Aristoteles, bestehend aus fünf radiär angeordneten Zähnen. Dieser Kauapparat fehlt wie die Stacheln vielen „Irregularia“. Die Irregularia entwickelten einen Vorderende als auch einen Hinterende. Der After ist hierbei an den Hinterrand oder auf die Unterseite verschoben.
7 Echinodermatenentwicklung als Indikator bei Forschung außerhalb der Entwicklungsbiologie
Auch außerhalb der Entwicklungsbiologie werden Echinodermaten als Modellorganismen genutzt.
Aufgrund des Calcium-Skeletts, dessen Entwicklung empfindlich auf pH-Veränderungen reagiert, dient die Entwicklung der Larven von Echinodermaten auch als Indikator zur Erforschung von möglichen Auswirkungen einer erhöhten Acidität der Meere aufgrund der globalen Erwärmung.
Ein abnehmender pH-Wert verursachte dabei in Experimenten eine geringere Größe der Larven, sowie eine Zunahme an Fehlbildungen während der Entwicklung, während eine Zunahme der Temperatur zu einem schnelleren Wachstum und zu größeren Larven führte und damit den Schäden, welche durch erhöhte Acidität entstanden, entgegen wirkte (Abb. 12, Brennant et al. 2010).
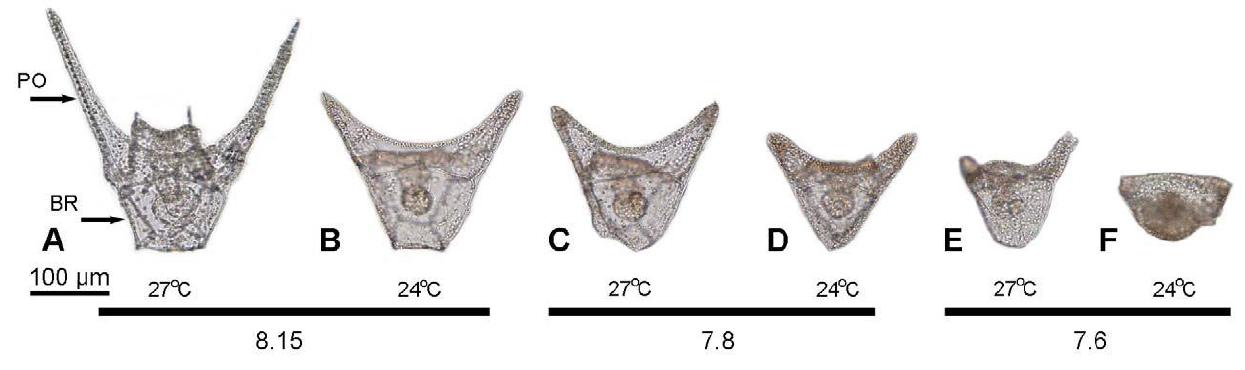
Abb. 11 Studien zu den Auswirkungen der globalen Erwärmung und mit ihr einhergehender Übersäuerung der Meere. Auswirkungen eines verringertem pH-Wertes bei unterschiedlichen Temperaturen am Beispiel der Larven von Tripneustes gratilla. Brennant et al. 2010, PLoS ONE.
Lizenz: Creative Commons Attribution License
8 Literatur
Shepard Brennand H, Soars N, Dworjanyn SA, Davis AR, Byrne M. 2010. Impact of Ocean Warming and Ocean Acidification on Larval Development and Calcification in the Sea Urchin Tripneustes gratilla. PLoS ONE 5(6): e11372.
Byrne M, Nakajima Y, Chee FC, Burke RD. 2007. Apical organs in echinoderm larvae: insights into larval evolution in the Ambulacraria. Evolution & Development 9: 432-445.
Ji C, Wu L, Zhao W, Wang S, Lv J. 2012. Echinoderms have bilateral tendencies. PloS one 7: e28978.
Mooi R, David B. 2008. Radial Symmetry, the Anterior/Posterior Axis, and Echinoderm Hox Genes. Annual Review of Ecology Evolution and Systematics 39: 43-62.
Pawson DL. 2007. Phylum Echinodermata. Zootaxa: 749-764.
Raff RA, Byrne M. 2006. The active evolutionary lives of echinoderm larvae. Heredity 97: 244-252.
Rast JP, Smith LC, Loza-Coll M, Hibino T, Litman GW. 2006. Review – Genomic insights into the immune system of the sea urchin. Science 314: 952-956.
Smith LC, et al. 2011. Echinoderm immunity. Advances in experimental medicine and biology 708: 260-301.
Vellutini BC, Migotto AE. 2010. Embryonic, Larval, and Juvenile Development of the Sea Biscuit Clypeaster subdepressus (Echinodermata:
Clypeasteroida). PLoS ONE 5(3): e9654.
[printfriendly]